
����Ŀ��Ϊ�˺������û�ѧ�ܣ�ȷ����ȫ���������������Ҫ��ֿ��ǻ�ѧ��Ӧ�ķ�Ӧ�ȣ�����ȡ��Ӧ��ʩ����ѧ��Ӧ�ķ�Ӧ��ͨ����ʵ����вⶨ��Ҳ�ɽ����������㣮
��1��ʵ���ã�5g�״���CH3OH��Һ���������г��ȼ�����ɶ�����̼�����Һ̬ˮʱ�ͷų�113.5kJ�����������ʾ�״���ȼ���ȵ��Ȼ�ѧ����ʽΪ��__________��
��2���������������Ȼ�ѧ����ʽ����a______b��������������=������������
H2��g��+![]() O2��g��=H2O��g����H1=akJmol-1
O2��g��=H2O��g����H1=akJmol-1
H2��g��+![]() O2��g��=H2O��l����H2=bkJmol-1
O2��g��=H2O��l����H2=bkJmol-1
��3����1mol��̬������ij�ֹ��ۼ���Ҫ���յ������м��ܣ��ӻ�ѧ���ĽǶȷ�������ѧ��Ӧ�Ĺ��̾��Ƿ�Ӧ��Ļ�ѧ�����ƻ���������Ļ�ѧ�����γɹ��̣��ڻ�ѧ��Ӧ�����У���ѧ����Ҫ�����������γɻ�ѧ���ֻ��ͷ�������
��ѧ�� | H-H | N-H | N��N |
����/kJmol-1 | 436 | 391 | 945 |
��֪��ӦN2��g��+3H2��g��=2NH3��g����H=akJmol-1���Ը��ݱ������м������ݹ���a��ֵ��____________��ע����+������-������
��4�����ݸ�˹���ɿ��Զ�ijЩ����ͨ��ʵ��ֱ�Ӳⶨ�Ļ�ѧ��Ӧ�ķ�Ӧ�Ƚ������㣮����ˮú���ϳɶ����ѵ�������Ӧ���£�
��2H2��g��+CO��g��=CH3OH��g������H=-90.8kJmol-1
��2CH3OH��g��=CH3OCH3��g��+H2O��g������H=-23.5kJmol-1
��CO��g��+H2O��g��=CO2��g��+H2��g������H=-41.3kJmol-1
�ܷ�Ӧ��3H2��g��+3CO��g��=CH3OCH3��g��+CO2��g������H=________________��
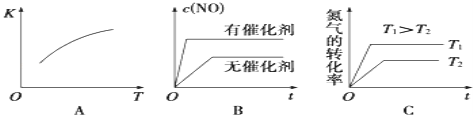
��5������β���ﺬ�е�NO������������ȼ��ȼ�յĸ�����������������Ӧ���£�N2��g��+O2��g��2NO��g����H��0����֪�÷�Ӧ��2 404�棬ƽ�ⳣ��K=64��10��4����ش�
�ٽ�N2��O2�Ļ�����������º����ܱ������У���ͼ�仯������ȷ����_____������ĸ��ţ���
�ڸ��¶��£�ijʱ�̲��������N2��O2��NO��Ũ�ȷֱ�Ϊ2.5��10��1 mol/L��4.0��10��2 mol/L��3.0��10��3 mol/L����ʱ��Ӧ_______���������ڻ�ѧƽ��״̬������������Ӧ����������������淴Ӧ�������������������_______��
���𰸡�CH3OH��g��+![]() O2��g��=CO2��g��+2H2O��l�� ��H=-726.4KJ/mol �� -93 -246.4kJmol-1 AC ������Ӧ������� ��ΪQc=
O2��g��=CO2��g��+2H2O��l�� ��H=-726.4KJ/mol �� -93 -246.4kJmol-1 AC ������Ӧ������� ��ΪQc= ��64��10��4�����Է�Ӧ������Ӧ�������
��64��10��4�����Է�Ӧ������Ӧ�������
��������
��1������5g�״���Ӧ�ų�����������1mol�״���Ӧ�ų���������д����ȷ���Ȼ�ѧ����ʽ��
��2����������ʽ��ˮ��״̬��ͬ������̬ˮ��ΪҺ̬ˮ�ų��������ݴ��жϣ�
��3��������H=��Ӧ����ܼ���-��������ܼ��ܽ��м��㣻
��4�����ݸ�˹���ɽ��м��㣻
��5�������¶ȡ������Է�Ӧ���ʺ�ƽ���ƶ���Ӱ������жϣ�
��1��5g�״���Ӧ�ų�������Ϊ113.5kJ�������32g�״���Ӧ�ų�������Ϊ726.4kJ���Ȼ�ѧ����ʽΪCH3OH��g��+![]() O2��g��=CO2��g��+2H2O��l�� ��H=-726.4KJ/mol��
O2��g��=CO2��g��+2H2O��l�� ��H=-726.4KJ/mol��
��2����������ʽ��ˮ��״̬��ͬ������̬ˮ��ΪҺ̬ˮ�ų�������b��Ӧ�ų���������a�࣬����a��b���Ǹ���������a��b��
��3����H=��Ӧ����ܼ���-��������ܼ���=945 kJ/mol+3��436 kJ/mol-2��3��391 kJ/mol
=-93 kJ/mol����a=- 93��
�ɸ�˹������2����+��+�ۣ���H=-90.8kJmol-1��2+��-23.5kJmol-1��+��-41.3kJmol-1��=-246.4 kJmol-1��
��5��A. ���ɷ�ӦN2��g��+O2��g��2NO��g����H��0����֪���÷�ӦΪ���ȷ�Ӧ�������¶�ƽ�����ƣ�Kֵ����A����ȷ��
B.��Ӧ�м����������Ӧ��������ƽ�ⲻ�ƶ���B�����
C.�¶����߷�Ӧ��������ƽ�����ƣ�������ת��������C����ȷ��
��ѡAC��
�� N2��g��+ O2��g�� 2NO��g����ijʱ��������N2��O2��NO��Ũ�ȷֱ�Ϊ2.5��10��1��4.0��10��2 ��3.0��10��3 mol/L��Qc=![]() ����K=64��10��4��Qc��K����֪ƽ�������ƶ���
����K=64��10��4��Qc��K����֪ƽ�������ƶ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��п������ͭ���仯������������������Ź㷺Ӧ�á��ش��������⣺
(1)��̬Fe3���ĺ�������Ų�ʽΪ____________���ڵ������ڹ���Ԫ���У���̬ԭ��δ�ɶԵ���������Ԫ��Ϊ____________(��Ԫ�ط��ű�ʾ)��
(2)һˮ�ϸʰ���п[(H2NCH2COO)2Zn��H2O]��һ���������Ӽ����û����������漰�ķǽ���Ԫ�ص縺���ɴ�С��˳����____________(��Ԫ�ط��ű�ʾ)���ʰ��������Nԭ�ӵ��ӻ��������Ϊ____________���ӽṹ�ǶȽ��ʰ���������ˮ��ԭ��________________��
(3)ͭԪ�صĵ�һ�����ܡ��ڶ������ֱܷ�Ϊ746 kJ��mol��1��1958 kJ��mol��1��пԪ�صĵ�һ�����ܡ��ڶ������ֱܷ�Ϊ906 kJ��mol��1��1733 kJ��mol��1��ͭ�ĵڶ������ܴ���п�ĵڶ������ܣ�����Ҫԭ����___________________________________________________��
(4)������(FePO4)����������������﮵�ز��ϣ�PO![]() �Ŀռ乹��Ϊ______________��
�Ŀռ乹��Ϊ______________��
(5)ij�ֻ�������Fe��Cu��S����Ԫ����ɣ��侧���ṹ��ͼ��ʾ����ѧʽΪ__________���þ����ϡ��µ����Ϊ�����Σ���������洹ֱ�����þ�����ܶ��� g��cm��3����NAΪ�����ӵ�������ֵ�����ͼ�е����ݼ�������ⳤa��____________(ֻҪ���г�����ʽ���ú�b�Ĵ���ʽ��ʾ)pm��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ�ﵽ����ʵ��Ŀ�ģ���Ӧ��ʵ�鷽���Լ���ؽ��;���ȷ����
ѡ�� | ʵ��Ŀ�� | ʵ�鷽�� | ��ؽ��� |
A | ������ˮ��pH |
| pH��ֽ������ |
B | ̽��������C5H12���ѽ� |
| C5H12�ѽ�Ϊ���ӽ�С��������ϩ�� |
C | ʵ���¶ȶ�ƽ���ƶ���Ӱ�� |
| 2NO2 |
D | ��AlCl3��Һ�Ʊ�AlCl3���� |
| AlCl3�е�����ܼ�ˮ |
A.AB.BC.CD.D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1���밴��ϵͳ������Ϊ��������������
 ___
___
![]() ___
___
![]() ___
___
��2����д��2��3��������4���һ���2����ϩ�Ľṹ��ʽ��___��
��3����д���ɱ��Ʊ��������Ļ�ѧ��Ӧ����ʽ___��
��4��ij�������ֲ�������з����һ�ֺ����Ĵ�����A������ṹ��ʽ��ͼ��

���ݿ�����ѧ֪ʶ���ô��ɷ����ķ�Ӧ������___������ĸ��ţ�
A.�����Na��Ӧ B.��CuO��Ӧ
C.������������Һ��Ӧ D.��ȥ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʱ���ķ�չ����ɫ��������Խ��Խ�ܵ���ҵ���ͬ�����Ϊ��������ÿһλ����Ӧ�����ɵ���ʶ��ijͬѧ�����÷Ͼɵ�������������Ϊԭ���ϡ����á���������������ȡ�������岢����һϵ�е�����̽����
��ȡ����������Ҫ�漰�������ĸ����裺
��һ��������Ʒ���ܽ⡣ȡһ��������Ʒ������250mL��ƿ�У�����һ��Ũ�Ⱥ������ǿ����Һ��ˮԡ����(Լ93��)������Ӧ��ȫ��(��������������)�����ȼ�ѹ���ˣ��ռ���Һ��250mL�ձ��У�
�ڶ����������������������ɡ�����Һ��������ˮԡ���У���3 mol/L H2SO4������ҺpH��8��9���õ�������ɫ����״Al(OH)3����ѹ���˵õ�������
����������������Һ�����ɡ�������ת����250mL�ձ��У����ȱߵ���һ��Ũ�Ⱥ������H2SO4��Һ��
���IJ�������������Һ���γɡ�������ȫ���ܽ�����һ�����Ĺ���K2SO4�����õ��ı��ͳ�����Һ��ȴ����ֱ������ȫ����������ѹ���ˡ�ϴ�ӡ���ɣ���ò�Ʒ��������[KAl(SO4)2��12H2O��M��474g/mol]��
�ش��������⣺
(1)��һ�������ܽ�������漰������Ҫ��Ӧ�����ӷ���ʽΪ__________________________
(2)Ϊ�˼ӿ�����Ʒ���ܽ⣬Ӧ�ö�����Ʒ����������Ԥ������________________________
(3)���IJ������У�Ϊ�˱�֤��Ʒ�Ĵ��ȣ�ͬʱ�ּ��ٲ�Ʒ����ʧ��Ӧѡ��������Һ�е�___(��ѡ����ĸ)����ϴ�ӣ�ʵ��Ч����ѡ�
A.�Ҵ� B.����K2SO4��Һ C.����ˮ D.1��1�Ҵ�ˮ��Һ
(4)Ϊ�˲ⶨ������������Ĵ��ȣ���������ʵ�������ȷ��ȡ������������4.0g���ձ��У�����50mL 1mol/L��������ܽ⣬��������Һת����100mL����ƿ�У�ϡ�����̶��ߣ�ҡ�ȣ���ȡ25.00 mL��Һ��250 mL��ƿ�У�����30 mL 0.10mol/L EDTA��2Na����Һ���ٵμӼ���2D���ӳȣ���ʱ��Һ�ʻ�ɫ����������һϵ�в�����������0.20 mol/Lп����Һ�ζ�����Һ�ɻ�ɫ��Ϊ�Ϻ�ɫ���ﵽ�ζ��յ�ʱ��������5.00 mLп����Һ���ζ�ԭ��ΪH2Y2����Al3����AlY����2H����H2Y2��(����)��Zn2����ZnY2����2H��(ע��H2Y2����ʾEDTA��2Na����Һ����)����������������Ĵ���Ϊ_________%��
(5)�������˿�������������Ϥ�ľ�ˮ��֮�⣬������������ʳƷ�����ɼ�����������(��)������������Ҫ����һ�������������������������ʳ�������������ɼ���ԭ����_______
(6)Ϊ��̽����������Ľᾧˮ��Ŀ���ֽ�����N2�����н����ȷֽ�ʵ�飬�õ�����������ȷֽ�������ͼ��ʾ(TG%�������Ƿֽ��ʣ���������ռ��Ʒԭʼ�����İٷ��ʣ�ʧ�ذٷ��ʣ�![]() ��100%)��
��100%)��
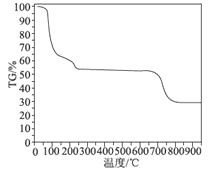
����TG���߳��ֵ�ƽ̨��ʧ�ذٷ��ʣ�30��270�淶Χ�ڣ�ʧ����ԼΪ45.57%��680��810�淶Χ�ڣ�ʧ�ذٷ���ԼΪ25.31%����ʧ����ԼΪ70.88%����ֱ�д�����漰��30��270�桢680��810���¶ȷ�Χ���������ε��ȷֽⷽ��ʽ��___________��_____________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1��ij����С��ͬѧ����ͼ1װ�ý���ʵ�飬�Իش��������⣺
��������K��a���ӣ����������绯ѧ��ʴ�е�______��ʴ��ʯī�缫�ϵĵ缫��ӦʽΪ______��

��������K��b���ӣ����ⷴӦ�Ļ�ѧ����ʽΪ______��
��2����С��ͬѧ���룬���ģ�ҵ�����ӽ���Ĥ�����ռ�ķ���������2ͼ��ʾװ�õ����������Һ����ȡ������������������������ƣ����۴ӽ�ʡ��Դ���Ǵ����ԭ�ϵ������ʶ��Զ����ӷ�����ɫ��ѧ���
�ٸõ��۵�������ӦʽΪ______����ʱͨ�������ӽ���Ĥ��������______��ѡ��������������С����������������ͨ�������ӽ���Ĥ����������
��ͨ�翪ʼ������������ҺpH______��ѡ��������������������������С������
�������Ƶõ�����������������������Һ���Ϊ����ȼ�ϵ�أ����ظ����ĵ缫��ӦʽΪ______����֪H2��ȼ����Ϊ285.8KJ/mol�����ȼ�ϵ�ع�������36gҺ̬H2Oʱ����������______kJ������ת��Ϊ���ܣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������С���������(ZVI)�ĵ绯ѧ��ʴ����������ϩ������ˮ�����Ĺ�����ͼ��ʾ��H+��O2��![]() �ȹ�����Ĵ��ڻ�Ӱ��ˮ����Ч�������嵥λʱ����ZVI�ͷŵ��ӵ����ʵ���Ϊnt������������Ч��ʴ�ĵ��ӵ����ʵ���ne������˵���������
�ȹ�����Ĵ��ڻ�Ӱ��ˮ����Ч�������嵥λʱ����ZVI�ͷŵ��ӵ����ʵ���Ϊnt������������Ч��ʴ�ĵ��ӵ����ʵ���ne������˵���������

A.��Ӧ�٢ڢܾۢ�����������
B.�ܵĵ缫��ӦʽΪ![]() +10H++8e-=
+10H++8e-=![]() +3H2O
+3H2O
C.��λʱ���ڣ�������ϩ��ȥamolClʱne=amol
D.����λ���ˮ����С��ZVI��Ͷ��������ʹnt����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������Ǵ�����Ⱦ��֮һ���û���̿��һ����̼��ԭ��������ɷ�ֹ������Ⱦ���ش��������⣺
��֪��2C(s)+O2(g)=2CO(g) ��H=-221 kJ/mol
C(s)+O2(g)=CO2(g) ��H=-393.5 kJ/mol
N2(g)+O2(g)=2NO(g) ��H=+181 kJ/mol
��1����ij��Ӧ��ƽ�ⳣ������ʽΪK=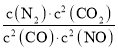 ����д���˷�Ӧ���Ȼ�ѧ����ʽ��_______�����д�ʩ�ܹ�����˷�Ӧ��NO��ת���ʵ��ǣ�����ĸ���ţ�____________��
����д���˷�Ӧ���Ȼ�ѧ����ʽ��_______�����д�ʩ�ܹ�����˷�Ӧ��NO��ת���ʵ��ǣ�����ĸ���ţ�____________��
a����������ѹǿ b�������¶� c��ʹ�����ʴ��� d������CO��Ũ��
��2�����ݻ�Ϊ2L���ܱ������м������̿(����)��NO��������ӦC(s)+2NO(g)![]() N2(g)+CO2(g)��NO��N2�����ʵ����仯���±���ʾ��
N2(g)+CO2(g)��NO��N2�����ʵ����仯���±���ʾ��
���ʵ���/mol | T1/�� | T2/�� | |||||
0 | 5 min | 10 min | 15 min | 20 min | 25 min | 30 min | |
NO | 2.0 | 1.16 | 0.80 | 0.80 | 0.50 | 0.40 | 0.40 |
N2 | 0 | 0.42 | 0.60 | 0.60 | 0.75 | 0.80 | 0.80 |
��0��5min�ڣ���CO2��ʾ�ĸ÷�Ӧ����v(CO2)=______���������µ�ƽ�ⳣ��K=_____��
�ڵ�15 min���¶ȵ�����T2�����ݱ仯���ϱ���ʾ����T1_______T2������������������������������
����30minʱ������T2���䣬����������ټ�������ַ�Ӧ������2 mol�����ʱ��Ӧ_______�ƶ�������������
��3����ҵ�Ͽ����ð�ˮ��ȥ��ӦC(s)+2NO(g)![]() N2(g)+CO2(g)�в�����CO2���õ�NH4HCO3��Һ����ӦNH4++HCO3-+H2O
N2(g)+CO2(g)�в�����CO2���õ�NH4HCO3��Һ����ӦNH4++HCO3-+H2O![]() NH3��H2O+H2CO3��ƽ�ⳣ��K=____________������֪������NH3��H2O�ĵ���ƽ�ⳣ��Kb=2��10-5��H2CO3�ĵ���ƽ�ⳣ��Ka1=4��10-7��Ka2=4��10-11��ˮ�����ӻ�����Kw=1��10-14��
NH3��H2O+H2CO3��ƽ�ⳣ��K=____________������֪������NH3��H2O�ĵ���ƽ�ⳣ��Kb=2��10-5��H2CO3�ĵ���ƽ�ⳣ��Ka1=4��10-7��Ka2=4��10-11��ˮ�����ӻ�����Kw=1��10-14��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������м������ʣ�
A.![]() H��D��T B��
H��D��T B��![]() C��
C��![]() C��
C��![]() C C��O2��O3 D�����ʯ��ʯī E��
C C��O2��O3 D�����ʯ��ʯī E�� 
F��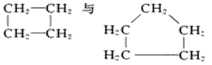 G��
G��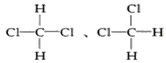
(���Ӧ��ĸ)
(1)����ͬλ�ص���___________________________��
(2)����ͬ�����������_______________________;
(3)����ͬ���칹�����______________________;
(4)����ͬϵ�����__________________________��
(5)����ͬһ�����ʵ���______________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com