
| A、标准状况下,11.2L乙烯含有的极性共价键数为NA |
| B、常温下,5.6LNO和5.6LO2的混合气体中含有的分子数为0.5NA |
| C、16.9gBaO2固体中阴、阳离子总数为0.2NA |
| D、含有1molFe(OH)3的氢氧化铁胶体中含有胶粒数为NA |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
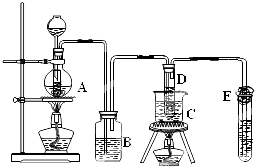 在实验室里制备KClO3,可利用如图所示的装置.实验中的化学原理:
在实验室里制备KClO3,可利用如图所示的装置.实验中的化学原理:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2.24L C4H6中含有碳碳叁键数一定为0.1×6.02×1023 |
| B、在标准状态下,11.2L NO与11.2L O2混合后气体分子数为0.75NA |
| C、含1mol FeCl3的饱和溶液滴入沸水中得到氢氧化铁胶体粒子数目为NA |
| D、106g Na2CO3固体中的阴离子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将少量AgNO3溶液滴入氨水中:Ag++2NH3?H2O═[Ag(NH3)2]++2H2O |
| B、将少量SO2通入NaClO溶液中:SO2+2ClO-+H2O═SO32-+2HClO |
| C、澄清石灰水与稀硝酸反应:Ca(OH)2+2H+═2H2O+Ca2+ |
| D、水玻璃长时间放置在空气中:SiO32-+CO2═H2SiO3↓+HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、 图中曲线表示向等体积、等物质的量浓度的盐酸和醋酸溶液中,分别加入足量镁粉,产生H2的物质的量的变化 |
B、 图表示用0.1000mol/L NaOH溶液分别滴定浓度相同的三种一元酸,由曲线可确定③的酸性最强 |
C、 图为水的电离平衡曲线图,若从A点到C点,可采用在水中加入适量NaOH固体的方法 |
D、 图表示将pH相同的NH4Cl溶液和HCl溶液稀释相同的倍数时,二者pH的变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、盐桥的作用是让电子通过,以构成闭合回路 |
| B、总反应为:2H++Zn═H2+Zn2+且△H<0 |
| C、随着反应进行,右烧杯中溶液pH变小 |
| D、随着反应进行,左烧杯溶液中的SO42-向右烧杯迁移 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2O2、Na2CO3 |
| B、NaOH、Na2CO3 |
| C、Na2CO3 |
| D、Na2O2、NaOH、Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、锌作负极 |
| B、铜片上有气泡产生 |
| C、将电能转化为化学能 |
| D、锌片的电极反应式为:Zn-2e-=Zn2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com