
|
35.2 g FeS与1000 mL 1.3 mol/L硝酸溶液恰好完全反应,反应后氧化产物为Fe2(SO4)3和Fe(NO3)3,则硝酸的还原产物为 | |
| [ ] | |
A. |
N2 |
B. |
N2O |
C. |
NO |
D. |
NO2 |
科目:高中化学 来源: 题型:阅读理解
 本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容.请选定其中一题,并在相应和答题区域内作答.若两题都做,则按A题评分.
本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容.请选定其中一题,并在相应和答题区域内作答.若两题都做,则按A题评分.
| 电离能/kJ?mol-1 | I1 | I2 |
| 铜 | 746 | 1958 |
| 锌 | 906 | 1733 |
| NaNO3 | KNO3 | NaCl | KCl | |
| 10℃ | 80.5 | 20.9 | 35.7 | 31.0 |
| 100℃ | 175 | 246 | 39.1 | 56.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
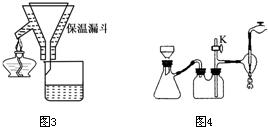
A. 海底热液研究(图1)处于当今科研的前沿。海底热液活动区域“黑烟囱”的周围常存在FeS、黄铜矿及锌矿等矿物。
(1) Ni2+的核外电子排布式是____________________。
(2) 分析下表,铜的第一电离能(I1)小于锌的第一电离能,而铜的第二电离能(I2)却大于锌的第二电离能,基主要原因是 。
| 电离能/kJ·mol-1 | I1 | I2 |
| 铜 | 746 | 1958 |
| 锌 | 906 | 1733 |
(3) 下列说法正确的是________。
A. 电负性:N>O>S>C B. CO2与COS(硫化羰)互为等电子体
C. NH3分子中氮原子采用sp3杂化 D. CO、H2S、HCN都是极性分子
(4) “酸性热液”中大量存在一价阳离子,结构如图2,它的化学式为________________。
(5) FeS与NaCl均为离子晶体,晶胞相似,前者熔点为985℃,后者801℃,其原因是____________________________________________。在FeS晶胞中,与Fe2+距离相等且最近的S2-围成的多面体的空间构型为________________。
B. 制备KNO3晶体的实质是利用结晶和重结晶法对KNO3和NaCl的混合物进行分离。下面是某化学兴趣小组的活动记录:
|
| NaNO3 | KNO3 | NaCl | KCl |
| 10℃ | 80.5 | 20.9 | 35.7 | 31.0 |
| 100℃ | 175 | 246 | 39.1 | 56.6 |
查阅资料:文献中查得,四种盐在不同温度下的溶解度(S/g)如下表:
实验方案:
Ⅰ. 溶解:称取29.8g KCl和34.0g NaNO3放入250mL烧杯中,再加入70.0g蒸馏水,加热并搅拌,使固体全部溶解。
Ⅱ. 蒸发结晶:继续加热和搅拌,将溶液蒸发浓缩。在100℃时蒸发掉50.0g 水,维持该温度,在保温漏斗(如图所示)中趁热过滤析出的晶体。得晶体m1g。
Ⅲ. 冷却结晶:待溶液冷却至室温(实验时室温为10℃)后,进行减压过滤。得KNO3粗产品m2g。
Ⅳ. 重结晶:将粗产品全部溶于水,制成100℃的饱和溶液,冷却至室温后抽滤。得KNO3纯品。
假定:① 盐类共存时不影响各自的溶解度;② 各种过滤操作过程中,溶剂的损耗忽略不计。试回答有关问题:
(1) 操作Ⅱ中趁热过滤的目的是 。
(2) 若操作Ⅱ中承接滤液的烧杯中不加入蒸馏水,则理论上在操作Ⅲ中可得粗产品的质量m2=______g,其中混有NaCl______g。为防止NaCl混入,在操作Ⅱ中承接滤液的烧杯中至少应加入蒸馏水______g。
(3) 操作Ⅲ中采用减压过滤,其优点是______________________________________。该小组同学所用的装置如右图所示,试写出该装置中主要用到的玻璃仪器的名称:________________。若实验过程中发现倒吸现象,应采取的措施是______________________________________。
查看答案和解析>>
科目:高中化学 来源:2011届江苏省南京市金陵中学高三第四次模拟考试(理综)化学部分 题型:填空题
A. 海底热液研究(图1)处于当今科研的前沿。海底热液活动区域“黑烟囱”的周围常存在FeS、黄铜矿及锌矿等矿物。
(1) Ni2+的核外电子排布式是____________________。
(2) 分析下表,铜的第一电离能(I1)小于锌的第一电离能,而铜的第二电离能(I2)却大于锌的第二电离能,基主要原因是 。
| 电离能/kJ·mol-1 | I1 | I2 |
| 铜 | 746 | 1958 |
| 锌 | 906 | 1733 |
| | NaNO3 | KNO3 | NaCl | KCl |
| 10℃ | 80.5 | 20.9 | 35.7 | 31.0 |
| 100℃ | 175 | 246 | 39.1 | 56.6 |
 案:
案:
 100℃的饱和溶液,冷却至室温后抽滤。得KNO3纯品。
100℃的饱和溶液,冷却至室温后抽滤。得KNO3纯品。
查看答案和解析>>
科目:高中化学 来源:2010-2011学年江苏省南京市高三第四次模拟考试(理综)化学部分 题型:填空题
A. 海底热液研究(图1)处于当今科研的前沿。海底热液活动区域“黑烟囱”的周围常存在FeS、黄铜矿及锌矿等矿物。
(1) Ni2+的核外电子排布式是____________________。
(2) 分析下表,铜的第一电离能(I1)小于锌的第一电离能,而铜的第二电离能(I2)却大于锌的第二电离能,基主要原因是 。

|
电离能/kJ·mol-1 |
I1 |
I2 |
|
铜 |
746 |
1958 |
|
锌 |
906 |
1733 |
(3) 下列说法正确的是________。
A. 电负性:N>O>S>C B. CO2与COS(硫化羰)互为等电子体
C. NH3分子中氮原子采用sp3杂化 D. CO、H2S、HCN都是极性分子
(4) “酸性热液”中大量存在一价阳离子,结构如图2,它的化学式为________________。
(5) FeS与NaCl均为离子晶体,晶胞相似,前者熔点为985℃,后者801℃,其原因是____________________________________________。在FeS晶胞中,与Fe2+距离相等且最近的S2-围成的多面体的空间构型为________________。
B. 制备KNO3晶体的实质是利用结晶和重结晶法对KNO3和NaCl的混合物进行分离。下面是某化学兴趣小组的活动记录:
|
|
NaNO3 |
KNO3 |
NaCl |
KCl |
|
10℃ |
80.5 |
20.9 |
35.7 |
31.0 |
|
100℃ |
175 |
246 |
39.1 |
56.6 |
查阅资料:文献中查得,四种盐在不同温度下的溶解度(S/g)如下表:
实验方案:
Ⅰ. 溶解:称取29.8g KCl和34.0g NaNO3放入250mL烧杯中,再加入70.0g蒸馏水,加热并搅拌,使固体全部溶解。
Ⅱ. 蒸发结晶:继续加热和搅拌,将溶液蒸发浓缩。在100℃时蒸发掉50.0g 水,维持该温度,在保温漏斗(如图所示)中趁热过滤析出的晶体。得晶体m1g。

Ⅲ. 冷却结晶:待溶液冷却至室温(实验时室温为10℃)后,进行减压过滤。得KNO3粗产品m2g。
Ⅳ. 重结晶:将粗产品全部溶于水,制成100℃的饱和溶液,冷却至室温后抽滤。得KNO3纯品。
假定:① 盐类共存时不影响各自的溶解度;② 各种过滤操作过程中,溶剂的损耗忽略不计。试回答有关问题:
(1) 操作Ⅱ中趁热过滤的目的是 。
(2) 若操作Ⅱ中承接滤液的烧杯中不加入蒸馏水,则理论上在操作Ⅲ中可得粗产品的质量m2=______g,其中混有NaCl______g。为防止NaCl混入,在操作Ⅱ中承接滤液的烧杯中至少应加入蒸馏水______g。
(3) 操作Ⅲ中采用减压过滤,其优点是______________________________________。该小组同学所用的装置如右图所示,试写出该装置中主要用到的玻璃仪器的名称:________________。若实验过程中发现倒吸现象,应采取的措施是______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)已知25℃时有关弱酸的电离平衡常数:
| 弱酸化学式 | HSCN | CH3COOH | HCN | H2CO3 |
| 电离平衡常数 | 1.3×10—1 | 1.8×10—5 | 4.9×10—10 | K1=4.3×10—7 K2=5.6×10—11 |

①等物质的量浓度的a.CH3COONa、b.NaCN、c.Na2CO3、d.NaHCO3溶液的pH由大到小的顺序为 (填序号)。
②25℃时,将20 mL 0.1 mol·L—1 CH3COOH溶液和
20 mL 0.1 mol·L—1HSCN溶液分别与20 mL 0.1 mol·L—1
NaHCO3溶液混合,实验测得产生的气体体积(V)
随时间(t)的变化如右图所示:反应初始阶段
两种溶液产生CO2气体的速率存在明显差异的原因是
。
反应结束后所得两溶液中,c(CH3COO—) c(SCN—)
(填“>”、“<”或“=”)
③若保持温度不变,在醋酸溶液中加入少量盐酸,下列量会变小的是______(填序号)。

a. c(CH3COO-) b. c(H+)
c. Kw d. 醋酸电离平衡常数
(2)右图为某温度下,PbS(s)、ZnS(s)、FeS(s)分别
在溶液中达到沉淀溶解平衡后,溶液的S2—浓度、金属
阳离子浓度变化情况。如果向三种沉淀中加盐酸,最
先溶解的是 (填化学式)。向新生成的ZnS浊液
中滴入足量含相同浓度的Pb2+、Fe2+的溶液,振荡后,ZnS
沉淀会转化为 (填化学式)沉淀。
(3)甲烷燃料电池可以提升能量利用率。下图是利用甲烷
燃料电池电解50 mL 2 mol·L—1的氯化铜溶液的装置示意图:
请回答:
① 甲烷燃料电池的负极反应式是 。
② 当线路中有0.1 mol电子通过时, 极增重________g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com