
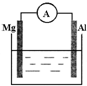
 如图所示装置中,金属镁、铝和电流表通过导线相连:
如图所示装置中,金属镁、铝和电流表通过导线相连:

 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案科目:高中化学 来源: 题型:
| 阳离子 | Na+、K+、Cu2+ | ||
| 阴离子 | SO
|

| ||
| ||
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:黑龙江省期中题 题型:填空题

查看答案和解析>>
科目:高中化学 来源:2010-2011学年黑龙江省哈尔滨三中高一(下)期中化学试卷(解析版) 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com