
Ⅰ.某实验小组把CO2通入饱和Na2CO3溶液制取NaHCO3,装置如图所示(气密性已检验,部分夹持装置略):

(1)请结合化学平衡移动原理解释B中溶液的作用?? ??????????????????????? ??? 。
(2)当D中有大量白色固体析出时,停止实验,将固体过滤、洗涤,取一定量配成样液,并加入BaCl2溶液,出现白色沉淀并有气体产生,其离子方程式是?? ??????????????????????????????? ?? 。
Ⅱ.某课外活动小组欲利用氨气与CuO反应,研究氨气的性质并测其组成,设计了如下实验(夹持装置未画出)进行实验。请回答下列问题:

(1)仪器b中可选择的试剂为(任意填一种)???????????? 。
(2)实验中,装置C中黑色CuO粉末全部转化为红色固体(已知Cu2O也为红色固体),量气管中有无色无味的气体。实验前称取黑色CuO 80g,实验后得到红色固体质量为68g。则红色固体成分的化学式为?????????????? 。
(3)F中读取气体体积前,应向上或向下移动右管,使得左右两边液面相平,若无此操作,而F中左边液面低于右边液面,会导致读取的气体体积??????? (填“偏大”或“偏小”或“无影响”)。
(4)要想测得氨气分子中氮、氢原子个数比,实验中应至少测量或读取哪些数据??????? (填序号)。
a.B装置实验前后质量差mg;???? b.F装置实验前后液面差VL
c.D装置实验前后质量差mg;???? d.E装置实验前后质量差mg;
(5)E装置中浓硫酸的作用是????????????????????????????????????????????????? 。
Ⅰ.(1)CO2在水中存在平衡:CO2+H2O H2CO3
H2CO3 HCO3-+H+,有H2SO4存在时,可使上述平衡向左移动,从而减少CO2在水中的溶解,同时吸收挥发出来的HCl气体(3分)[给分要点:吸收HCl气体、减少CO2在水中的溶解、H2SO4电离出的H+使平衡左移]
HCO3-+H+,有H2SO4存在时,可使上述平衡向左移动,从而减少CO2在水中的溶解,同时吸收挥发出来的HCl气体(3分)[给分要点:吸收HCl气体、减少CO2在水中的溶解、H2SO4电离出的H+使平衡左移]
(2)2HCO3-+Ba2+=BaCO3↓+ CO2↑+H2O(3分)
Ⅱ.(1)碱石灰或生石灰或氢氧化钠固体(任意填一种)(2分)
(2)Cu和Cu2O(3分)??? (3)偏小(2分)?? (4)b、c(3分)
(5)防止F中水蒸气进入D中,并吸收氨气(2分)
【解析】
试题分析:Ⅰ.(1)7mol?L?1的盐酸与CaCO3反应制取的CO2气体中含有HCl,硫酸溶液可吸收HCl,CO2能溶于水,存在平衡::CO2+H2O H2CO3
H2CO3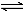 HCO3-+H+,H2SO4电离产生H+,使上述平衡向左移动,从而减少CO2在水中的溶解。
HCO3-+H+,H2SO4电离产生H+,使上述平衡向左移动,从而减少CO2在水中的溶解。
(2)当D中有大量白色固体析出时,CO2、H2O与Na2CO3反应生成了NaHCO3,加入BaCl2溶液,出现白色沉淀为BaCO3,产生的气体为CO2,离子方程式为:2HCO3-+Ba2+=BaCO3↓+ CO2↑+H2O
Ⅱ.(1)碱石灰或生石灰或氢氧化钠固体都能与浓氨水作用,产生氨气。
(2)若CuO全部被还原为Cu,根据关系式:CuO ~ Cu,生成的Cu质量为:80g×64/80=64g;若CuO全部被还原为Cu2O,根据关系式:2CuO ~ Cu2O,生成的Cu2O质量为:80g×144/160=72g,实际得到红色固体质量为68g,则红色固体成分为Cu和Cu2O
(3)F中左边液面低于右边液面,说明左边气体压强大于右边,则会导致读取的气体体积偏小。
(4)F装置实验前后液面差VL,为NH3与CuO反应生成的N2的体积,可求出N原子的物质的量,D装置实验前后质量差mg,为NH3与CuO反应生成的H2O的质量,可求出H原子的物质的量,由二者可求出氨气分子中氮、氢原子个数比。
(5)因为D中碱石灰的作用是吸收NH3与CuO反应生成的H2O,所以E中浓硫酸可F中水蒸气进入D中,并吸收未反应的氨气。
考点:本题考查化学实验的分析、产物的判断、试剂的选择与作用、离子方程式的书写。


科目:高中化学 来源: 题型:阅读理解
| ||
| ||
 N2+2CO2 将有害的污染物转化为可参与大气循环的N2和CO2.
N2+2CO2 将有害的污染物转化为可参与大气循环的N2和CO2.| 时间/h | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/mol?L-1 | 1.00×10-3 | 4.5×10-4 | 2.5×10-4 | 1.5×10-4 | 1.00×10-4 | 1.00×10-4 |
| c(CO)/mol?L-1 | 3.6×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源:2012-2013学年浙江省(六校)高三第一次联考理综化学试卷(解析版) 题型:填空题
碳酸二甲酯(DMC)是一种近年来受到广泛关注的环保型绿色化工产品。在催化剂作用下,可由甲醇和CO2直接合成DMC:CO2 + 2CH3OH → CO(OCH3)2 + H2O,但甲醇转化率通常不会超过1%是制约该反应走向工业化的主要原因。某研究小组在其他条件不变的情况下,通过研究温度、反应时间、催化剂用量分别对转化数(TON)的影响来评价催化剂的催化效果。计算公式为:TON=转化的甲醇的物质的量/催化剂的物质的量。
(1)已知25℃时,甲醇和DMC的标准燃烧热分别为△H1和△H2,则上述反应在25℃时的焓变△H3=_____。
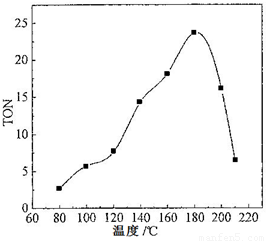
(2)根据反应温度对TON的影响图(下左图)判断该反应的焓变△H________0(填“>”、“=”或“<”),理由是________________________________。
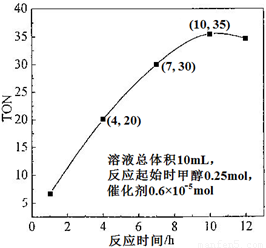
(3)根据反应时间对TON的影响图(上右图),已知溶液总体积10mL,反应起始时甲醇0.25mol,催化剂0.6×10—5 mol,计算该温度下,4~7 h内DMC的平均反应速率:________;计算10 h时,甲醇的转化率:________。
(4)根据该研究小组的实验及催化剂用量对TON的影响图(下图),判断下列说法正确的是___ __。
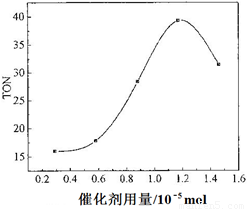
a. 由甲醇和CO2直接合成DMC,可以利用价廉易得的甲醇把影响环境的温室气体CO2转化为资源,在资源循环利用和环境保护方面都具有重要意义
b. 在反应体系中添加合适的脱水剂,将提高该反应的TON
c. 当催化剂用量低于1.2×10—5 mol时,随着催化剂用量的增加,甲醇的平衡转化率显著提高
d. 当催化剂用量高于1.2×10—5 mol时,随着催化剂用量的增加,DMC的产率反而急剧下降
查看答案和解析>>
科目:高中化学 来源:2009-2010学年河北省衡水中学高三(上)二调化学试卷(解析版) 题型:解答题
| 化学键 | Si-O | Si-Cl | H-H | H-Cl | Si-Si | Si-C | O=O |
| 键能/kJ?mol-1 | 460 | 360 | 436 | 431 | 176 | 347 | 498 |
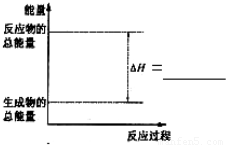
 Si(s)+4HCl(g),该反应的反应热△H=______
Si(s)+4HCl(g),该反应的反应热△H=______| 实验序号 | 起始温度t1/℃ | 终止温度t2/℃ | 温差(t2-t1) /℃ | ||
| 盐酸 | NaOH溶液 | 平均值 | |||
| 1 | 25.1 | 24.9 | 25.0 | 31.6 | 6.6 |
| 2 | 25.1 | 25.1 | 31.8 | 31.8 | 6.7 |
| 3 | 25.1 | 25.1 | 25.1 | 31.9 | 6.8 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com