
| A. | ②④⑤ | B. | ①③⑥ | C. | ①②⑤ | D. | ②④⑥ |
分析 ①Cu2+为蓝色;
②pH=11的溶液,显碱性;
③水电离的H+浓度为10-12mol•L-1的溶液,为酸或碱溶液;
④加入Mg能放出H2的溶液,显酸性;
⑤使甲基橙变红的溶液,显酸性;
⑥酸性溶液中该组离子之间发生氧化还原反应.
解答 解:①Cu2+为蓝色,与无色溶液不符,故错误;
②pH=11的溶液,显碱性,该组离子之间不反应,可大量共存,故正确;
③水电离的H+浓度为10-12mol•L-1的溶液,为酸或碱溶液,酸溶液中不能大量存在S2O32-,碱溶液中不能大量存在NH4+,故错误;
④加入Mg能放出H2的溶液,显酸性,该组离子之间不反应,可大量共存,故正确;
⑤使甲基橙变红的溶液,显酸性,该组离子之间不反应,可大量共存,故正确;
⑥酸性溶液中Fe2+、NO3-发生氧化还原反应,或NO3-分别与I-、S2-发生氧化还原反应,不能共存,故错误;
故选A.
点评 本题考查离子的共存,为高频考点,把握习题中的信息、常见离子之间的反应为解答的关键,侧重分析与应用能力的考查,注意复分解反应及氧化还还原反应的判断,题目难度不大.


 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | H3BO3的酸性比H2CO3的强 | |
| B. | Mg(OH)2的碱性比Be(OH)2的强 | |
| C. | C、N、O原子半径依次增大 | |
| D. | 若M+和R2-的核外电子层结构相同,则原子序数:R>M |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
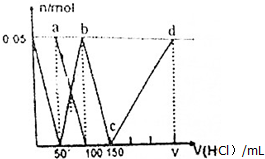
| A. | a点溶液中:c(HCO${\;}_{3}^{-}$)+c(H2CO3)+c(H+)=c(OH-) | |
| B. | 当向混合液中滴加75nL盐酸时,溶液中部分离子浓度大小顺序为:c(Na+)>c(Cl-)>c(CO${\;}_{3}^{2-}$)>c(OH-)>c(H+) | |
| C. | b点溶液中:c(Cl-)+c(HCO3-)+c(H2CO3)+c(CO${\;}_{3}^{2-}$)=1.5mol•L-1 | |
| D. | c→d的过程中水的电离程度逐渐减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验编号 | Ⅰ | Ⅱ | Ⅲ | Ⅳ |
| 10%H2O2的体积/mL | 5.0 | 5.0 | V1 | V2 |
| 20%硫酸的体积/mL | 0 | 0.5 | 1.0 | V3 |
| 水的体积/mL | 15 | 14.5 | V4 | 13.5 |
| 所需时间t/s | t1 | t2 | t3 | t4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生成的SO3中 | B. | O2和SO3中 | C. | 剩余的SO3中 | D. | O2、SO2和SO3中 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有少量硫的酒精溶液,加入大量水后形成乳白色液体,用滤纸过滤不能分离出硫 | |
| B. | 原硅酸溶液中加入硫酸铵饱和溶液,结果产生沉淀 | |
| C. | 硫酸铜溶液中加入硫化钠溶液产生黑色沉淀 | |
| D. | 用水稀释牛奶,用一束强光照射,从侧面观察,可以看到一条清晰的光路 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 第一组 | A-268.8 | B-249.5 | C-185.8 | D-151.7 |
| 第二组 | F2-187.0 | Cl2-33.6 | Br2 58.7 | I2 184.0 |
| 第三组 | HF 19.4 | HCl-84.0 | HBr-67.0 | HI-35.3 |
| 第四组 | H2O 100.0 | H2S-60.2 | H2Se 42.0 | H2Te-1.8 |
| A. | 第一组和第二组物质中一定含有共价键 | |
| B. | 第三组与第四组相比较,化合物的稳定顺序为:HBr>H2Se | |
| C. | 第三组物质溶于水后,溶液的酸性:HF>HCl>HBr>HI | |
| D. | 第四组物质中H2O的沸点最高,是因为H2O分子中化学键键能最强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com