
| A. | 3υ正(N2)=υ正(H2) | B. | υ正(N2)=υ逆(NH3) | C. | υ正(N2)=3υ逆(H2) | D. | 2υ正(H2)=3υ逆(NH3) |
科目:高中化学 来源: 题型:解答题
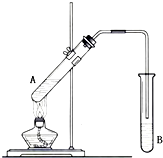 在试管A中加入2mL 乙醇,然后边振荡试管边慢慢加入3mL 浓硫酸和2mL 乙酸,按下图所示连接好装置进行实验,以制取乙酸乙酯.
在试管A中加入2mL 乙醇,然后边振荡试管边慢慢加入3mL 浓硫酸和2mL 乙酸,按下图所示连接好装置进行实验,以制取乙酸乙酯.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (用电子式表示).
(用电子式表示).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
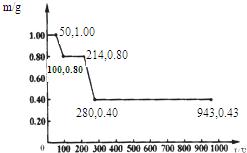 (1)用甲烷制氢是一种廉价的制氢方法.有关的热化学方程式如下:
(1)用甲烷制氢是一种廉价的制氢方法.有关的热化学方程式如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3 mol/L | B. | 0.3molL/(L•s) | C. | 0.6 molL/(L•s) | D. | 0.1 molL/(L•s) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
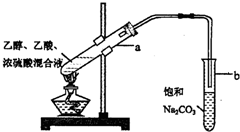
 CH3COOC2H5+H2O.
CH3COOC2H5+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用太阳能热水器、沼气利用、玉米制乙醇等都涉及到生物质能的利用 | |
| B. | 用新的无害的汽油添加剂代替四乙基铅抗震剂以减少污染 | |
| C. | 火力发电用煤先进行脱硫处理,积极开发风能、生物质能发电 | |
| D. | 绿色化学要求利用化学原理从源头消除污染,期望在化学反应和化学工业过程中充分利用参与反应的原料,实现零排放 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | S(g)+O2(g)═SO2(g)△H=a;S(s)+O2(g)═SO2(g)△H=b;则a>b | |
| B. | C(石墨,s)═C(金刚石,s)△H=+1.9 kJ/mol,则可判定石墨比金刚石稳定 | |
| C. | NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=-57.4 kJ/mol,则含20 g NaOH的溶液与稀盐酸完全反应,放出的热量为28.7 kJ | |
| D. | CaCO3(s)═CaO(s)+CO2(g)△H>0,则该反应任何温度下都能自发进行 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com