
【题目】某容器中通入V L CO2,再加入少量Na2O2后,气体体积缩小到W L,则被吸收的CO2的体积是(均为相同条件下)
A.(V—W)LB.2(V—W)LC.(2V—W)LD.2W L
科目:高中化学 来源: 题型:
【题目】为探究 Fe3+和 Cu2+对 H2O2 分解反应的催化效果,甲、乙两组同学分别设计了如图1、图 2所示的实验。下列叙述中不正确的是( )
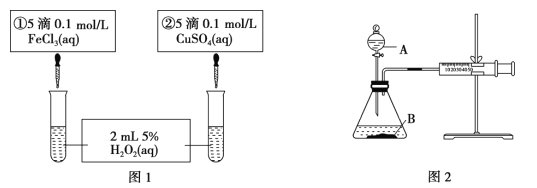
A. 图 1 实验可通过观察产生气泡的快慢来比较反应速率的大小
B. 若图 1 所示实验速率为①>②,则一定能说明 Fe3+比 Cu2+对 H2O2 分解催化效果好
C. 用图 2 装置比较反应速率,可测定相同时间相同状况产生气体体积的多少进行比较
D. 图 2 中将注射器活塞拉出一定距离,一段时间后松开活塞,能返回原处,则不漏气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组探究SO2气体的还原性,装置如图所示,下列说法不合理的是
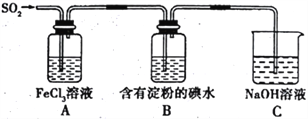
A. 为了验证A 中发生了氧化还原反应,加入稀盐酸酸化的BaCl2溶液,产生白色沉淀
B. 该实验装置至少存在一处设计缺陷
C. 向反应后的A 溶液中加入酸性KMnO4溶液,紫红色褪去,说明一定有Fe2+
D. 装置B是为了验证还原性: SO2>I-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列物质的电离方程式:
H2CO3_________________;
NaHCO3_________________;
K2SO4___________________;
NH4NO3__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢氧化铈[Ce(OH)4]是一种重要的稀土化合物。以氟碳铈矿(主要含CeFCO3)为原料制备Ce(OH)4的一种工艺流程如下:
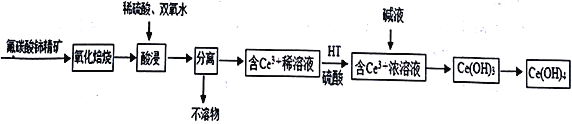
已知:在酸性溶液中Ce4+有强氧化性。回答下列问题:
(1) “氧化焙烧”前需将矿石粉碎成细颗粒,其目的是_________________________,化合物CeFCO3 中Ce 的化合价为________________________。
(2)氧化焙烧生成的铈化合物为二氧化铈(CeO2),其在酸浸时发生反应的离子方程式为__________________________________,酸浸时不宜温度过高的原因是____________________。
(3)已知有机物HT 能将Ce3+从水溶液中萃取出来,该过程可表示为:2 Ce3+ (水层) +6HT (有机层)![]() 2CeT3 (有机层) +6H+ (水层)
2CeT3 (有机层) +6H+ (水层)
从平衡移动角度解释: 向CeT3(有机层) 加入H2SO4获得较纯的含Ce3+的水溶液的原因是____________________。
(4)Ce(OH)3暴露于空气中时变成紫色,最终变成黄色的Ce(OH)4,该反应的化学方程式为________________________________。
(5)已知298 K 时,Ksp[Ce(OH)3]=1×10-20,为了使溶液中Ce3+沉淀完全,需调节pH为______以上。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛、铁、镓、砷的单质及其化合物在生产生活中有重要的应用。回答下列问题;
(1)写出As的基态原子的电子排布式_________________________。
(2)N、P、As为同一主族元素,其电负性由大到小的顺序为_________________________,它们的氢化物沸点最高的是___________,原因为____________________________。
(3)Fe3+、Co3+与N3-、CN-等可形成络合离子。
①K3[Fe(CN)6]可用于检验Fe2+,配体CN-中碳原子杂化轨道类型为_________________。
②[Co(N3) (NH3)5]SO4中Co的配位数为________________,其配离子中含有的化学键类型为______(填离子键、共价键、配位键),C、N、O的第一电离能最大的为_______________,其原因是__________________________。
(4)砷化镓晶胞结构如下图。晶胞中Ga与周围等距且最近的As形成的空间构型为_____________。已知砷化镓晶胞边长为apm,其密度为ρg·cm-3,则阿伏加德罗常数的数值为_______(列出计算式即可)。
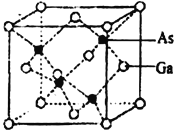
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知三氯化铁的熔点为306℃,沸点为315℃,易溶于水并且有强烈的吸水性,能吸收空气里的水分而潮解。某学习小组的同学对氯气与铁的反应及产物做了如下探究实验:
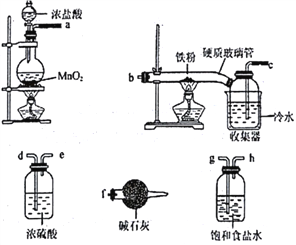
(1)装碱石灰的仪器是____________(填仪器名称),碱石灰的作用______________________。
(2)装置的连接顺序为_________________________。
(3)反应一段时间后熄灭酒精灯,冷却后将硬质玻璃管及收集器中的物质一并快速转移
至锥形瓶中,加入过量的稀盐酸和少许植物油(反应过程中不振荡),充分反应后,进行如下实验:
![]()
①固体混合物的成分是_____________________。(填化学式)
②淡黄色溶液中加入试剂X生成淡红色溶液的离子反应方程式为_______________________________。
(4)已知红色褪去的同时有气体生成,经检验为O2。该小组内的同学们对红色褪去的原因提出了三种假设。
假设I:H2O2还原Fe3+,使其转变为Fe2+;
假设Ⅱ:H2O2分解生成O2,O2氧化试剂X;
假设Ⅲ:__________________________________。(如果表达中遇到试剂X,请写出其化学式)。
并对假设进行了以下实验研究:
①取褪色后溶液三份,第一份滴加FeCl3溶液无明显变化;第二份滴加试剂X,溶液出现红色;第三份滴加稀盐酸和BaCl2溶液,产生白色沉淀。
②另取同浓度的 FeCl3溶液滴加2滴试剂X,溶液变红,再通入O2,无明显变化。 实验①说明假设__________不正确; 实验②的目的是_______________;由实验①②得出假设________是正确的。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分枝酸可用于生化研究。其结构简式如图。下列关于分枝酸的叙述正确的是
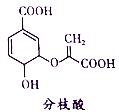
A. 分子中含有2种官能团
B. 可与乙醇、乙酸反应,且反应类型相同
C. 1mol分枝酸最多可与3molNaOH发生中和反应
D. 可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 24 g 镁与27 g铝中,含有相同的质子数
B. 同等质量的氧气和臭氧中,电子数相同
C. 1 mol重水与1 mol水中,中子数比为2∶1
D. 1 mol乙烷和1 mol乙烯中,化学键数相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com