
【题目】室温下,将1.000 mol·L-1盐酸滴入20.00 mL 1.000 mol·L-1氨水中,溶液pH和温度随加入盐酸体积变化曲线如图所示。下列有关说法正确的是( )
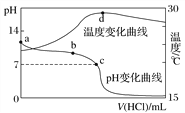
A. a点由水电离出的c(H+)=1.0×10-14 mol·L-1
B. b点:c(NH![]() )+c(NH3·H2O)=c(Cl-)
)+c(NH3·H2O)=c(Cl-)
C. c点:c(Cl-)=c(NH![]() )
)
D. d点后,溶液温度略下降的主要原因是NH3·H2O电离吸热
 春雨教育同步作文系列答案
春雨教育同步作文系列答案科目:高中化学 来源: 题型:
【题目】高科技材料与生活、生产、科技密切相关。下列关于2017年我国重点发展的科技材料说法错误的是
A. 生物塑料可减少白色污染
B. 用于“天宫二号”的纳米陶瓷铝合金硬度大
C. 高性能分离膜可用于海水淡化
D. 用于3D打印材料的光敏树酯是纯净物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用括号内的试剂除去下列各组物质中含有的少量杂质,正确的是( )
A. 溴苯中的溴(NaOH溶液,分液)
B. 乙酸乙酯中的乙醇(乙酸,分液)
C. 苯中的苯酚(浓溴水,过滤)
D. 乙醇中的乙酸(饱和Na2CO3溶液,分液)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【2015天津卷】废旧印刷电路板是一种电子废弃物,其中铜的含量达到矿石中的几十倍。湿法技术是将粉碎的印刷电路板经溶解、萃取、电解等操作得到纯铜等产品。某化学小组模拟该方法回收铜和制取胆矾,流程简图如下:

回答下列问题:
(1)反应Ⅰ是将Cu转化为Cu(NH3 )42+,反应中H2O2 的作用是 。写出操作①的名称: 。
(2)反应II是铜氨溶液中的Cu(NH3 )42+与有机物RH反应,写出该反应的离子方程式: 。操作②用到的主要仪器名称为 ,其目的是(填序号) 。
a.富集铜元素
b.使铜元素与水溶液中的物质分离
c.增加Cu2+在水中的溶解度

(3)反应Ⅲ是有机溶液中的CuR2与稀硫酸反应生成CuSO4和 。若操作③使用如图装置,图中存在的错误是 。
(4)操作④以石墨作电极电解CuSO4 溶液。阴极析出铜,阳极产物是 。操作⑤由硫酸铜溶液制胆矾的主要步骤是 。
(5)流程中有三次实现了试剂的循环使用,已用虚线标出两处,第三处的试剂是 。循环使用的NH4Cl在反应Ⅰ中的主要作用是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 蛋白质是生命的基础,是人类必需的营养物质
B. 维生素C又称抗坏血酸,新鲜蔬菜中富含维生素C
C. 阿司匹林是常用的解热镇痛药,可以长期大量服用
D. 葡萄糖是自然界中分布最广的单糖,在人体中发生氧化反应,放出能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【2015安徽卷】硼氢化钠(NaBH4)在化工等领域具有重要的应用价值,某研究小组采用偏硼酸钠NaBO2为主要原料制备NaBH4,其流程如下:

已知:NaBH4常温下能与水反应,可溶于异丙酸(沸点:13℃)。
(1)在第①步反应加料之前,需要将反应器加热至100℃以上并通入氩气,该操作的目的是_____,原料中的金属钠通常保存在____中,实验室取用少量金属钠需要用到的实验用品有_____,_____,玻璃片和小刀等。
(2)请配平第①步反应的化学方程式:
□NaBO2+□SiO2+□Na+□H2==□NaBH4+□Na2SiO3
(3)第②步分离采用的方法是______;第③步分离(NaBH4)并回收溶剂,采用的方法是______。
(4)NaBH4(s)与水(l)反应生成NaBO2(s)和氢气(g),在25℃,101KPa下,已知每消耗3.8克NaBH4(s)放热21.6KJ,该反应的热化学方程式是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【2015浙江卷】某学习小组按如下实验流程探究海带中碘含量的测定和碘的制取。
实验(一) 碘含量的测定
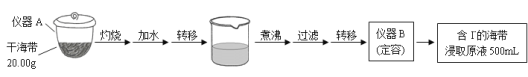
取0.0100 mol·Lˉ1的AgNO3标准溶液装入滴定管,取100.00 mL海带浸取原液至滴定池,用电势滴定法测定碘含量。测得的电动势(E) 反映溶液中c(Iˉ)的变化,部分数据如下表:
V(AgNO3)/mL | 15.00 | 19.00 | 19.80 | 19.98 | 20.00 | 20.02 | 21.00 | 23.00 | 25.00 |
E/mV | -225 | -200 | -150 | -100 | 50.0 | 175 | 275 | 300 | 325 |
实验(二) 碘的制取
另制海带浸取原液,甲、乙两种实验方案如下:
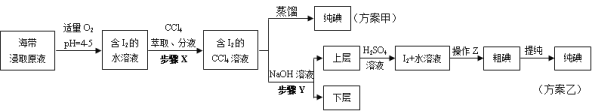
已知:3I2+6NaOH=5NaI+NaIO3+3H2O。
请回答:
(1)实验(一) 中的仪器名称:仪器A , 仪器 B 。
(2)①根据表中数据绘制滴定曲线:
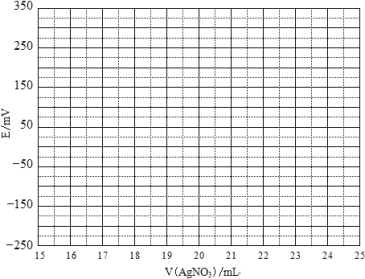
②该次滴定终点时用去AgNO3溶液的体积为 mL,计算得海带中碘的百分含量为 %。
(3)①分液漏斗使用前须检漏,检漏方法为 。
②步骤X中,萃取后分液漏斗内观察到的现象是 。
③下列有关步骤Y的说法,正确的是 。
A.应控制NaOH溶液的浓度和体积
B.将碘转化成离子进入水层
C.主要是除去海带浸取原液中的有机杂质
D.NaOH溶液可以由乙醇代替
④实验(二) 中操作Z的名称是 。
(4)方案甲中采用蒸馏不合理,理由是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,有两种溶液:①0.01 mol·L-1 NH3·H2O溶液、②0.01 mol·L-1 NH4Cl溶液,下列操作可以使两种溶液中c(NH4+)都增大的是
A.通入少量HCl气体 B.加入少量NaOH固体
C.加入少量H2O D.适当升高温度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com