
【题目】在一定温度下,将2.4 mol A和1.2 mol B两种气体相混合后于容积为2 L的某密闭容器中,发生如下反应A(g)+B(g)![]() xC(g)+D(g) △H<0,2 min末达到平衡状态,生成了0.8 mol D,并测得C的浓度为0.4 mol/L,请填写下列空白:
xC(g)+D(g) △H<0,2 min末达到平衡状态,生成了0.8 mol D,并测得C的浓度为0.4 mol/L,请填写下列空白:
(1)x值等于________________,2 min内v(B)= 。
(2)A的转化率为_________________。
(3)该反应达到平衡时,再向容器中加入1.2 molA和0.6 molB,再次达到平衡后,A的转化率 (填“增大”、“减小”或“不变”) 。
(4)该反应的平衡常数的表达式K= ,450℃时平衡常数___________500℃时平衡常数(填“大于”、“小于”或“等于”)。
(5)相同温度下,若起始时向该容器中充入0.4 mol A、0.4 mol B、0.2 molC和0.2 molD,反应达到平衡前,反应速率v正 v逆(填“>” 或 “<”),达到平衡时D的浓度为 。
【答案】(1)1 0.2mol/(L·min)
(2)33.3% (3)不变
(4)c(C)·c(D)/c(A)·c(B) 大于
(5)>(2分) 0.15mol/L
【解析】
试题分析:在一定温度下,将2.4molA和1.2molB两种气体相混合后于容积为2L的某密闭容器中,2min末反应达到平衡状态,生成了0.8molD,并测得C的浓度为0.4mol/L,生成C为0.4mol/L×2=0.8mol,则:
A(g)+B(g)![]() xC(g)+D(g)
xC(g)+D(g)
起始量(mol):2.4 1.2 0 0
变化量(mol):0.8 0.8 0.8 0.8
平衡量(mol):1.6 0.4 0.8 0.8
(1)物质的量之比等于化学计量数之比,所以0.8mol:0.8mol=x:1,解得x=1;v(B)=![]() =0.2mol/(L.min);
=0.2mol/(L.min);
(2)A的转化率=![]() ×100%=33.3%;
×100%=33.3%;
(3)该反应达到平衡时,再向容器中加入1.2molA和0.6molB,等效为在原平衡基础上增大压强,反应前后气体的体积不变,增大反应体系的压强,平衡不移动,A的转化率不变;
(4)A(g)+B(g)![]() C(g)+D(g)的化学平衡常数表达式K=c(C)·c(D)/c(A)·c(B);正反应为放热反应,升高温度平衡逆向移动,平衡常数减小,450℃时平衡常数大于500℃时平衡常数;
C(g)+D(g)的化学平衡常数表达式K=c(C)·c(D)/c(A)·c(B);正反应为放热反应,升高温度平衡逆向移动,平衡常数减小,450℃时平衡常数大于500℃时平衡常数;
(5)反应前后气体物质的量不变,用物质的量代替浓度计算平衡常数,则K=c(C)·c(D)/c(A)·c(B)=![]() =1,此时浓度商Qc=
=1,此时浓度商Qc=![]() =0.25<K=1,反应向正反应进行,则v正>v逆,设平衡时转化的A为ymol,则:
=0.25<K=1,反应向正反应进行,则v正>v逆,设平衡时转化的A为ymol,则:
A(g)+B(g)![]() C(g)+D(g)
C(g)+D(g)
起始量(mol):0.4 0.4 0.2 0.2
变化量(mol):y y y y
平衡量(mol):0.4-y 0.4-y 0.2+y 0.2+y
所以(0.2+y)×(0.2+y)/(0.4y)×(0.4y)=1,解得y=0.1
故平衡时D的浓度为0.3mol÷2L=0.15mol/L。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 所有的放热反应都能在常温常压下自发进行
B. Ba(OH)2·8H2O与NH4Cl反应属放热反应
C. 天然气燃烧时,其化学能全部转化为热能
D. 反应热只与反应体系的始态和终态有关,而与反应的途径无关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学反应能用离子方程式H++OH﹣═H2O表示的是( )
A.硫酸氢钠溶液与氢氧化钾溶液反应
B.稀硫酸与氢氧化钡溶液反应
C.稀硝酸与氢氧化铜反应
D.醋酸与氢氧化钠溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.久置的氯水最终会变成稀盐酸
B.硅酸钠的水溶液俗称“水玻璃”,是工业常用的黏合剂、阻燃剂、防腐剂
C.漂白粉在空气中容易变质,应密封保存
D.液氯可用钢瓶贮存,所以氯气与金属不反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下a mol·L-1稀氨水和b mol·L-1稀盐酸等体积混合,对混合后溶液判断一定正确的是( )
A. 若a=b,则c(NH4+)=c(Cl-)
B. 若a>b,则c(NH4+)>c(Cl-)
C. 若a>b,则c(OH-)>c(H+)
D. 若a<b,则c(OH-)<c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有含淀粉、NaCl、Na2SO4、CaCl2的混合溶液,选择适当的试剂和方法从中提纯出NaCl晶体,相应的实验过程如下:
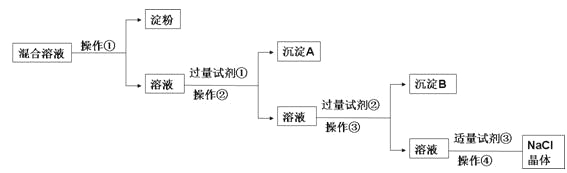
(1)操作①是利用胶体不能通过__________而把淀粉胶体和溶液进行分离。
(2)写出上述实验过程中所用试剂的化学式:试剂①__________;试剂③__________。
(3)判断试剂①已过量的操作是:静置,向上层清液中_____________。
(4)控制试剂③适量的方法是:__________。操作④的名称是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空。
(1)浓度均为0.1 mol/L的①硫酸 ②醋酸 ③氢氧化钠 ④氯化铵四种溶液中由水电离出的H+浓度由大到小的顺序是 (填序号)。
(2)Fe2(SO4)3溶液显酸性,用离子方程式表示其原因___________________。
(3)AlCl3溶液和NaAlO2溶液混合的化学方程式为______________________。
(4)向饱和FeCl3溶液中加入CaCO3粉末,发现碳酸钙逐渐溶解,同时还产生的现象有____________________。
(5)常温下,将0.2 mol/L CH3COOH和0.1 mol/L NaOH溶液等体积混合,所得溶液的pH<7,该混合溶液中离子浓度由大到小的顺序是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,水的离子积常数Kw=1×10-12。该温度下,将pH=4的H2SO4溶液与pH=9的NaOH溶液混合并保持恒温,欲使混合溶液的pH=7,则稀硫酸与NaOH溶液的体积比为( )
A. 1∶10 B. 9∶1 C. 1∶9 D. 99∶21
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com