
【题目】取两份铝片,第一份与足量盐酸反应,第二份与足量烧碱溶液反应,同温同压下放出相同体积的气体,则两份铝片的质量之比为
A. 1:6B. 2:3C. 3:2D. 1:1
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】紫菜与海带类似,是一种富含生物碘的海洋植物.商品紫菜轻薄松脆、比海带更易被焙烧成灰实验室里从紫菜中提取碘的流程如图1: 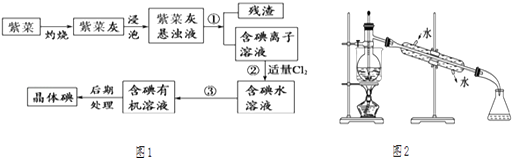
(1)实验室焙烧紫菜,需要下列仪器中的(填序号).
a.试管 b.烧杯 c.坩埚 d.泥三角 e.铁三脚架 f.酒精灯
(2)指出提取碘的过程中有关的实验操作名称:① , ③ .
(3)提取碘的过程中,可选择的有机试剂是
A.酒精 B.苯 C.乙酸 D.食盐水
选择该试剂的理由是 .
(4)为使紫菜灰中碘离子转化为碘的有机溶液,实验室有烧杯、玻璃棒、集气瓶、酒精灯、导管、圆底烧瓶、石棉网以及必要的夹持仪器、物品,尚缺少的玻璃仪器有、 .
(5)从含碘的有机溶液中提取碘和回收有机溶剂,还须经过蒸馏,观察图2中的实验装置图改正其中的错误之处:
①;②;③ .
(6)进行上述蒸馏操作时,使用水浴加热,最后晶态碘在里聚集.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,将气体X和气体Y各0.16mol充入 10L恒容密闭容器中,发生反应X(g)+Y(g)2Z(g)△H<0,一段时间后达到平衡.反应过程中测定的数据如下表:下列说法正确的是( )
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
A.反应前2min的平均速率v(Z)=4.0×10﹣3mol/(Lmin)
B.其他条件不变,降低温度,反应达到新平衡前v(逆)>v(正)
C.该温度下此反应的平衡常数K=1.44
D.其他条件不变,再充入0.2molZ,平衡时X的体积分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验能达到目的的是( )
A. 用溴水鉴别苯和正己烷
B. 用BaCl2溶液鉴别SO42-与SO32-
C. 用浓HNO3与Cu反应制备NO2
D. 将混有HCl的Cl2通入饱和NaHCO3溶液中除去HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机化合物的说法正确的是( )
A.乙醇和乙酸都存在碳氧双键
B.甲烷和乙烯都可以与氯气反应
C.酸性高锰酸钾可以氧化苯和乙醛
D.乙烯可以与氢气发生加成反应,而苯不能与氢气加成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸钠﹣过氧化氢加合物(xNa2SO4yH2O2zH2O)的组成可通过下列实验测定:①准确称取1.7700g样品,配制成100.00mL溶液A.②准确量取25.00mL溶液A,加入盐酸酸化的BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体0.5825g.③准确量取25.00mL溶液A,加适量稀硫酸酸化后,用0.02000molL﹣1KMnO4溶液滴定至终点,消耗KMnO4溶液25.00mL.H2O2与KMnO4反应的离子方程式如下:2MnO4﹣+5H2O2+6H+=2Mn2++8H2O+5O2↑
(1)已知室温下BaSO4的Ksp=1.1×10﹣10 , 欲使溶液中c(SO42﹣)≤1.0×10﹣6 molL﹣1 , 应保持溶液中c(Ba2+)≥molL﹣1 .
(2)上述滴定若不加稀硫酸酸化,MnO4﹣被还原为MnO2 , 其离子方程式为
(3)上述滴定到达终点的现象为
(4)通过计算确定样品的组成(写出计算过程).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种食用精制盐包装袋上有如表说明:
产品标准 | GB5461 |
产品等级 | 一级 |
配 料 | 食盐、碘酸钾、抗结剂 |
碘含量(以I计) | 20~50mg/kg |
分装时期 | |
分装企业 |
(1)碘酸钾与碘化钾在酸性条件下发生如下反应,配平化学方程式(将化学计量数填于空白处)KIO3+KI+H2SO4═K2SO4+I2+H2O
(2)上述反应生成的I2可用四氯化碳检验.向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳.
①Na2SO3稀溶液与I2反应的离子方程式是 .
②某学生设计回收四氯化碳的操作为:
a.将碘的四氯化碳溶液置于分液漏斗中;
b.加入适量Na2SO3稀溶液;
c.分离出下层液体d.将分液漏斗充分振荡后静置
其中分液漏斗使用前须进行的操作是 , 上述操作正确的顺序是:(填序号)
(3)已知:I2+2S2O32﹣═2I﹣+S4O62﹣ . 某学生测定食用精制盐的碘含量,其步骤为:
a.准确称取wg食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c.以淀粉为指示剂,逐滴加入物质的量浓度为2.0×10﹣3molL﹣1的Na2S2O3溶液10.0mL,恰好反应完全.
①判断c中反应恰好完全依据的现象是 .
②b中反应所产生的I2的物质的量是mol.
③根据以上实验和包装袋说明,所测精制盐的碘含量是(以含w的代数式表示)mg/kg.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用铝箔包装0.1mol金属钠,用针扎出一些小孔,放入水中,完全反应后,用排水集气法收集产生的气体,则收集到的气体为(标准状况)
A. O2和H2的混合气体B. 11.2L H2
C. 大于1.12L H2D. 小于1.12L H2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com