
【题目】如图为长式周期表的一部分,其中的编号代表对应的元素. 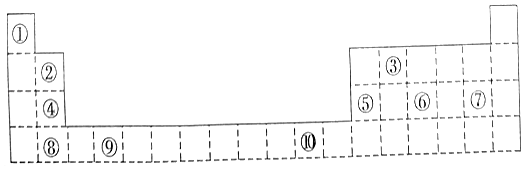
请回答下列问题:
(1)表中属于d区元素的是(填元素符号).
(2)⑥和⑦形成的分子中各个原子均满足8电子稳定结构,其立体构型为 .
(3)某元素原子的外围电子排布式为nsnnpn+1 , 该元素原子和⑦形成的分子,中心原子上的价层电子对数为 .
(4)元素⑦和⑧形成的化合物的电子式为 .
(5)元素⑩的基态+2价离子的电子排布式是 .
(6)某些不同族元素的性质也有一定的相似性,如上表中元素②与元素⑤的氢氧化物有相似的性质.请写出元素②的氢氧化物与NaOH溶液反应的化学方程式: .
【答案】
(1)Ti
(2)三角锥形
(3)4
(4)![]()
(5)1s22s22p63s23p63d9或[Ar]3d9
(6)Be(OH)2+2NaOH═Na2BeO2+2H2O
【解析】解:由元素在周期表中的位置可知,①为H,②为Be,③为C,④为Mg,⑤为Al,⑥为P,⑦为Cl,⑧为Ca,⑨为Ti,⑩为Cu,(1)d区元素在副族元素和过渡元素区,Cu位于ds区,只有Ti位于d区, 所以答案是:Ti;(2)P和Cl形成PCl3或PCl5 , 分子中各个原子能均满足8电子稳定结构的是PCl3 , 价层电子对数为3+ ![]() =4,孤对电子1对,则立体构型为三角锥形,所以答案是:三角锥形;(3)电子排布式为nsnnpn+1 , n只能为2,外围电子排布式为:2s22p3 , 则该元素为N,与Cl形成的分子为NCl3 , 价层电子对数为3+
=4,孤对电子1对,则立体构型为三角锥形,所以答案是:三角锥形;(3)电子排布式为nsnnpn+1 , n只能为2,外围电子排布式为:2s22p3 , 则该元素为N,与Cl形成的分子为NCl3 , 价层电子对数为3+ ![]() =4,所以答案是:4;(4)Cl和Ca形成的化合物氯化钙是离子化合物,电子式为:
=4,所以答案是:4;(4)Cl和Ca形成的化合物氯化钙是离子化合物,电子式为: ![]() ,
,
所以答案是: ![]() ;(5)元素⑩为Cu,核外电子是29个,它的基态原子核外电子排布式是:1s22s22p63s23p63d104s1或[Ar]3d104s1 , 二价阳离子的电子排布式为:1s22s22p63s23p63d9或[Ar]3d9 , 所以答案是:1s22s22p63s23p63d9或[Ar]3d9;(6)元素②的氢氧化物与NaOH溶液反应反应生成Na2BeO2 , 该反应为Be(OH)2+2NaOH═Na2BeO2+2H2O,所以答案是:Be(OH)2+2NaOH═Na2BeO2+2H2O.
;(5)元素⑩为Cu,核外电子是29个,它的基态原子核外电子排布式是:1s22s22p63s23p63d104s1或[Ar]3d104s1 , 二价阳离子的电子排布式为:1s22s22p63s23p63d9或[Ar]3d9 , 所以答案是:1s22s22p63s23p63d9或[Ar]3d9;(6)元素②的氢氧化物与NaOH溶液反应反应生成Na2BeO2 , 该反应为Be(OH)2+2NaOH═Na2BeO2+2H2O,所以答案是:Be(OH)2+2NaOH═Na2BeO2+2H2O.


 步步高达标卷系列答案
步步高达标卷系列答案科目:高中化学 来源: 题型:
【题目】将SO2分别通入下列4种溶液中,有关说法正确的是( ) 
A.试管a中实验可以证明SO2具有漂白性
B.试管b中溶液褪色,说明SO2具有强氧化性
C.试管c中能产生白色沉淀,说明SO2具有还原性
D.试管d中能产生白色沉淀,该沉淀完全溶于稀硝酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下 列离子方程式书写正确的是( )
A. 氯气通入水中:Cl2+H2O = 2H++Cl-+ClO-
B. 铁和稀硫酸反应:2Fe+6H+ = 2 Fe3++3H2↑
C. 碳酸钙与醋酸反应:CaCO3+2H+ = Ca2++CO2↑+H2O
D. 氢氧化铝和氢氧化钠溶液反应:Al(OH)3+OH- = AlO2-+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子,在无色、强酸性溶液中能大量共存的是( )
A.Mg2+、K+、SO42-、CO32-B.Na+、NO3-、Ac-、K+
C.Al3+、Na+、Cl-、SO42-D.Na+、K+、MnO4-、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由二氧化硅制高纯硅的流程如下,下列判断中错误的是

A. ①②③均属于氧化还原反应 B. H2和HCl均可循环利用
C. SiO2是一种坚硬难熔的固体 D. SiHCl3摩尔质量为135.5g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于硅及其化合物用途的叙述中,正确的有( )
A.Na2SiO3可用作助燃剂
B.SiO2可用作制造光导纤维
C.单晶硅可用于制造太阳能电池
D.Si可用作制造变压器铁芯的原料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、实验室采用MgCl2、AlCl3的混合溶液与过量氨水反应制备MgAl2O4,主要流程如下:
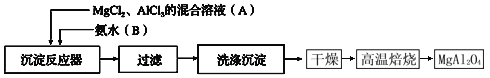
(1)写出AlCl3与氨水反应的化学反应方程式 _________________________________。
(2)判断流程中沉淀是否洗净所用的试剂是______________,高温焙烧时,用于盛放固体的仪器名称是 ________________。
Ⅱ、无水AlCl3(183 ℃升华)遇潮湿空气即产生大量白雾,实验室可用下列装置制备。
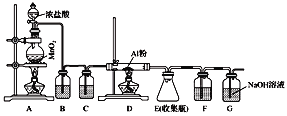
(3)其中装置A用来制备氯气,写出其离子反应方程式:______________________。
(4)装置B中盛放饱和NaCl溶液,该装置的主要作用是_____________________。
(5)F中试剂是________。G为尾气处理装置,其中反应的化学方程式:____________________。
(6)制备氯气的反应会因盐酸浓度下降而停止。为测定反应残余液中盐酸的浓度,探究小组同学提出下列实验方案:与足量AgNO3溶液反应,称量生成的AgCl质量。此方案_______(填“可行”,“不可行”),理由是__________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表中关于物质分类的正确组合是 ( )
类别组合 | 酸性氧化物 | 碱性氧化物 | 酸 | 碱 | 盐 |
A | CO2 | CuO | H2SO4 | NH3·H2O | Na2S |
B | CO | Na2O | HCl | NaOH | NaCl |
C | SO2 | Na2O2 | CH3COOH | KOH | CaF2 |
D | NO2 | CaO | HNO3 | Cu(OH)2CO3 | CaCO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com