
金属镁及其化合物不仅在国防上有重要应用,在化学研究中也有广泛应用。
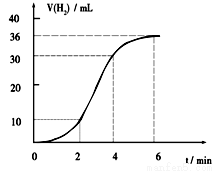
(1)某同学研究反应速率时用如下方法:取一段镁条,用砂纸擦去表面的氧化膜,使足量镁条与一定量盐酸反应生成H2的量与反应时间的关系曲线如图所示。镁与盐酸反应的离子方程式为 ;在前4min内,镁条与盐酸的反应速率逐渐加快,在4 min之后,反应速率逐渐减慢,请简述其原因:_____________。
(2)向少量的Mg(OH)2悬浊液中加入适量的饱和氯化铵溶液,固体完全溶解,写出NH4Cl饱和溶液使Mg(OH)2悬浊液溶解的离子方程式 。
(3)Mg Al可形成原电池:
编号 | 电极材料 | 电解质溶液 | 电子流动 方向 |
1 | Mg Al | 稀盐酸 | Mg流向Al |
2 | Mg Al | NaOH溶液 |
|
根据上表中的实验现象完成下列问题:
①实验1中Mg为 极;
②实验2中电子流动方向 ,Al为 极,为什么? 。
(1)Mg+2H+=Mg2++H2↑(1分)
镁和盐酸反应是放热反应,随着反应体系温度升高,反应速率增大(1分);
4min后由于溶液中H+浓度降低,所以导致反应速率减小(1分)。
(2)Mg(OH)2(s)+2NH4+=Mg2++2NH3·H2O(2分)
(3) ① 负极(1分)
②Al流向Mg(1分),负(1分),Al能和NaOH溶液反应而Mg不能,故Al作负极,Mg作正极。(2分)
【解析】
试题分析:(1)镁与盐酸发生置换反应,离子方程式为:Mg+2H+=Mg2++H2↑;因为金属与酸的置换反应为放热反应,所以镁与盐酸反应放热,随着反应体系温度升高,反应速率增大,随着反应的进行,H+浓度降低,4min后浓度对反应速率的影响为主要因素,反应速率减小。
(2)NH4+结合OH?,使Mg(OH)2的沉淀溶解平衡向右移动:Mg(OH)2(s)+2NH4+=Mg2++2NH3·H2O
(3) ①实验1在稀盐酸中,Mg比Al活泼,所以Mg为负极。
②实验2中,Al容易与NaOH溶液反应,而Mg不与NaOH溶液反应,所以Al为负极,则电子流动方向为:Al流向Mg。
考点:本题考查离子方程式的书写、条件对反应速率的影响、原电池原理。


科目:高中化学 来源:2015届江苏省扬州市高二上学期期末考试化学试卷(必修)(解析版) 题型:实验题
胆矾(CuSO4·5H2O)是铜的重要化合物,有着广泛的应用。以下是CuSO4·5H2O的实验室制备流程图。
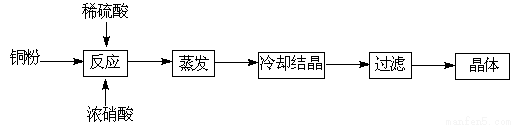
完成下列各题:
Ⅰ.(1)向含铜粉的稀硫酸中滴加浓硝酸,随着铜粉的溶解可能观察到的实验现象 、 。
(2)制得的胆矾晶体(CuSO4·5H2O)中可能存在的杂质是 (写化学式)。
(3)采用重量法测定CuSO4·5H2O的含量时,步骤如下:
①取样,称量 ②加水溶解 ③加氯化钡溶液生成沉淀 ④过滤(其余步骤省略)
在过滤前,需要检验是否沉淀完全,其操作是 。
Ⅱ. 某研究性学习小组用ZRY-1型热重分析仪对12.5克硫酸铜晶体(CuSO4·5H2O)进行热重分析,随温度的升高,硫酸铜晶体依次发生下列反应。
a.CuSO4·5H2O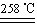 CuSO4+5H2O
CuSO4+5H2O
b.CuSO4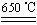 CuO+SO3↑,2SO3
CuO+SO3↑,2SO3 2SO2+O2
2SO2+O2
c.4CuO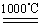 2Cu 2 O+O2↑
2Cu 2 O+O2↑
请回答下列问题:
(1)实验过程中热重分析仪测得残留固体质量为3.8 g,试推断该固体的组分是 (写化学式),其对应的物质的量之比是 。
(2)热重分析仪加热晶体至恒重后,将全部气体导出,通入氢氧化钡溶液充分反应,所得沉淀经过滤、洗涤、干燥,质量为 g。
查看答案和解析>>
科目:高中化学 来源:2015届山西省大同市高二上学期期末考试化学试卷(解析版) 题型:选择题
现有 0.4mol/L HA溶液和 0.2mol/L NaOH溶液等体积混合组成溶液。下列有关推断正确的是
若该溶液中HA电离能力大于A-水解能力,则有
c(Na+)>c(A-)>c(HA)>c(H+)>c(OH-)
B. 若该溶液中HA电离能力小于A-水解能力,则有
c(A-)>c(HA)>c(Na+)>c(OH-)>c(H+)
C. 无论该溶液呈酸性还是碱性,都有
c(A-)+ c(OH-)=c(Na+)+c(H+)
D. 无论该溶液呈酸性还是碱性,
c(Na+)=c(A-)+c(HA)
查看答案和解析>>
科目:高中化学 来源:2015届山东省济宁市高二3月质检化学试卷(解析版) 题型:选择题
某烃分子中有一个环状结构和两个双键,它的分子式可能是 ( )
A.C4H6 B.C7H8 C.C5H6 D.C10H6
查看答案和解析>>
科目:高中化学 来源:2015届山东省威海市高二上学期期末考试化学试卷(解析版) 题型:选择题
下列说法错误的是
A.常温下,将pH=3的醋酸溶液稀释到原体积的10倍后,溶液的pH小于4
B.为确定某酸H2A是强酸还是弱酸,可测NaHA溶液的pH。若pH>7,则H2A是弱酸;若pH<7,则H2A是强酸
C.用0.200 mol·L-1 NaOH标准溶液滴定HCl与CH3COOH的混合液(混合液中两种酸的浓度均约为0.1 mol·L-1),至中性时,溶液中的酸未被完全中和
D.相同温度下,将足量氯化银固体分别放入相同体积的①蒸馏水、②0.1 mol·L-1盐酸、③0.1 mol·L-1氯化镁溶液、④0.1 mol·L-1硝酸银溶液中,Ag+浓度: ④>①>②>③
查看答案和解析>>
科目:高中化学 来源:2015届山东省威海市高二上学期期末考试化学试卷(解析版) 题型:选择题
下列各离子方程式中,属于水解反应且使溶液显碱性的是
A.CH3COOH+OH-= CH3COO-+H2O
B.H2O+H2O  H3O++OH-
H3O++OH-
C.NH4+ + H2O  NH3·H2O + H+
NH3·H2O + H+
D.PO43-+H2O  HPO42-+OH-
HPO42-+OH-
查看答案和解析>>
科目:高中化学 来源:2015届天津市红桥区高二上学期期末考试化学试卷(解析版) 题型:选择题
下列实验基本操作正确的是
A.用碱式滴定管量取0.10 mol·L-1的Na2CO3溶液22.10 mL;
B.中和热测定实验中可以用环形铁丝搅拌棒代替环形玻璃搅拌棒
C.经实验测定等物质的量的盐酸、醋酸分别与足量NaOH溶液反应放出的热量相等
D.用玻璃棒蘸取溶液滴到湿润的广范pH试纸上,测其pH=3.6
查看答案和解析>>
科目:高中化学 来源:2015届天津市南开区高二上学期期末考试化学试卷(解析版) 题型:选择题
一定条件下,通过下列反应可以制备特种陶瓷的原料MgO:MgSO4(s)+CO(g) MgO(s)+CO2(g)+SO2(g) △H>0
MgO(s)+CO2(g)+SO2(g) △H>0
该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后;纵坐标y随x变化趋势合理的是
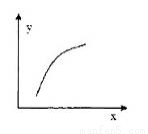
选项xy
A温度容器内混合气体的密度
BCO的物质的量CO2与CO的物质的量之比
CSO2的浓度平衡常数K
DMgSO4的质量(忽略体积)CO的转化率
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com