
| A、将pH=1的H2SO4和pH=3的HCl等体积混合,所得溶液pH=2 | ||
| B、HF比HCN易电离,则NaF溶液的pH比同浓度NaCN溶液的pH大 | ||
C、向0.1mol/L CH3COOH溶液中加入少量CH3COONa固体,溶液中
| ||
| D、将1mL pH=3的HX溶液稀释到10mL,若溶液的pH<4,则HX为弱酸 |
| 10-1+10-3 |
| 2 |
| 1 |
| 2 |
| c(H+) |
| c(CH3COOH) |


 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案科目:高中化学 来源: 题型:
| A、将pH=2的盐酸和pH=4的硫酸等体积混合,所得溶液pH=3 | ||
| B、HF比HCN易电离,则NaF溶液的pH比同浓度NaCN溶液的pH大 | ||
C、向0.1 mol/L氨水中加入少量硫酸铵固体,溶液中
| ||
| D、将1 mL pH=3的HA溶液稀释到10 mL,若溶液的pH<4,则HA为弱酸 |
查看答案和解析>>
科目:高中化学 来源:吉林省模拟题 题型:单选题
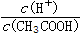 增大
增大 查看答案和解析>>
科目:高中化学 来源:吉林省期中题 题型:单选题
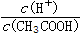 增大
增大 查看答案和解析>>
科目:高中化学 来源: 题型:
室温下,下列说法正确的是( )
A.将pH=2的盐酸和pH=4的硫酸等体积混合,所得溶液pH=3
B.HF比HCN易电离,则NaF溶液的pH比同浓度NaCN溶液的pH大
C.向0.1 mol/L氨水中加入少量硫酸铵固体,溶液中 ![]() 增大
增大
D.将1 mL pH=3的HA溶液稀释到10 mL,若溶液的pH<4,则HA为弱酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com