
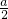 mol
mol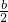 mol
mol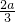 mol
mol Na2CO3+CO2↑+H2O↑
Na2CO3+CO2↑+H2O↑ 2Na2CO3+
2Na2CO3+ O2↑+H2O↑
O2↑+H2O↑  2Na2CO3+O2↑+2NaOH
2Na2CO3+O2↑+2NaOH  Na2CO3+CO2↑+H2O↑
Na2CO3+CO2↑+H2O↑ 2Na2CO3+
2Na2CO3+ O2↑+H2O↑
O2↑+H2O↑  2Na2CO3+O2↑+2NaOH
2Na2CO3+O2↑+2NaOH  n(Na2O2)=
n(Na2O2)=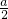 mol;若过氧化钠有剩余,则n(Na2O2):n(NaHCO3)>1:1,即a:b>1:1,此时生成的气体只有氧气,n(O2)=
mol;若过氧化钠有剩余,则n(Na2O2):n(NaHCO3)>1:1,即a:b>1:1,此时生成的气体只有氧气,n(O2)= n(NaHCO3)=
n(NaHCO3)=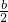 mol,故A错误;
mol,故A错误; <
<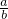 <1,即1<
<1,即1<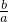 <2,a<b<2a,过氧化钠与碳酸氢钠都完全反应,令按反应Ⅰ进行反应的过氧化钠为xmol,则该反应中消耗碳酸氢钠为2xmol,按反应Ⅱ进行反应的过氧化钠为(a-x)mol,则该反应中消耗的碳酸氢钠为(a-x)mol,故:2xmol+(a-x)mol=bmol,解得x=(b-a),故n(H2O)=(b-a)mol,故0<n(H2O)<a,故D正确;
<2,a<b<2a,过氧化钠与碳酸氢钠都完全反应,令按反应Ⅰ进行反应的过氧化钠为xmol,则该反应中消耗碳酸氢钠为2xmol,按反应Ⅱ进行反应的过氧化钠为(a-x)mol,则该反应中消耗的碳酸氢钠为(a-x)mol,故:2xmol+(a-x)mol=bmol,解得x=(b-a),故n(H2O)=(b-a)mol,故0<n(H2O)<a,故D正确;

科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:2013-2014学年上海市八校高三年级联合调研考试化学试卷(解析版) 题型:选择题
将a molNa2O2和b mol NaHCO3固体混合后,在密闭容器中加热到250℃,让其充分反应。当排出气体为两种气体时,a : b 的值不可能是
A.1:1 B.1:2 C.2:3 D. 3: 2
查看答案和解析>>
科目:高中化学 来源:2012-2013学年湖北省荆州市高三毕业班质量检查(Ⅰ)化学试卷(解析版) 题型:选择题
将a molNa2O2和b mol NaHCO3固体混合后,在密闭容器中加热到250OC,让其充分反应。当剩余固体为Na2CO3、NaOH,排出气体为O2、H2O时,a/b值可能为
A.0.5 B.0.25 C. 0.85 D.1.0
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com