
| A. | 150 mL 1 mol•L-1 NaCl溶液 | B. | 75 mL 1 mol•L-1AlCl3溶液 | ||
| C. | 75 mL 2 mol•L-1CaCl2溶液 | D. | 200 mL 2 mol•L-1 KCl溶液 |
分析 根据同一化学式中各微粒的浓度等于物质的物质的量浓度×离子个数,与溶液的体积无关,如100mL 2mol•L-1 MgCl2溶液中氯离子浓度为:c(Cl-)=2mol/L×2=4mol/L,据此分析.
解答 解:100mL 2mol•L-1 MgCl2溶液中氯离子浓度为:c(Cl-)=2mol/L×2=4mol/L,.
A.150mL 1mol•L-1 NaCl溶液中Cl-的物质的量浓度为:c(Cl-)=c(NaCl)=1mol•L-1,故A错误;
B.75mL 1mol•L-1AlCl3溶液中Cl-的物质的量浓度为:c(Cl-)=3c(AlCl3)=3mol•L-1,故B错误;
C.75mL 2mol•L-1CaCl2溶液中Cl-的物质的量浓度为:c(Cl-)=2c(CaCl2)=4mol•L-1,故C正确;
D.150mL 2mol•L-1 KCl溶液中Cl-的物质的量浓度为:c(Cl-)=c(KCl)=2mol•L-1,故D错误;
故选C.
点评 本题考查了物质的量浓度的计算,题目难度不大,试题侧重基础知识的考查,注意掌握物质的量浓度的概念及计算方法,明确物质的量浓度与溶液体积大小无关.


 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓硝酸和浓硫酸都具有很强的腐蚀性、脱水性 | |
| B. | 冷的浓硫酸和浓硝酸都可以用铝、铁的容器盛装 | |
| C. | 稀硫酸和稀硝酸都具有氧化性 | |
| D. | 硫酸和硝酸都是重要的化工原料 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蒸馏、分液、萃取 | B. | 萃取、蒸馏、分液 | C. | 分液、蒸馏、萃取 | D. | 蒸馏、萃取、分液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在元素周期表前四周期中原子序数依次增大的六种元素A、B、C、D、E、F中,A与其余五种元素既不同周期也不同主族,B的一种核素在考古时常用来鉴定一些文物的年代,C的氧化物是导致酸雨的主要物质之一,D原子核外电子有8种不同的运动状态,E的基态原子在前四周期元素的基态原子中单电子数最多,F元素的基态原子最外能层只有一个电子,其它能层均已充满电子.
在元素周期表前四周期中原子序数依次增大的六种元素A、B、C、D、E、F中,A与其余五种元素既不同周期也不同主族,B的一种核素在考古时常用来鉴定一些文物的年代,C的氧化物是导致酸雨的主要物质之一,D原子核外电子有8种不同的运动状态,E的基态原子在前四周期元素的基态原子中单电子数最多,F元素的基态原子最外能层只有一个电子,其它能层均已充满电子. ; A2D由液态形成晶体时密度减小(填增大,不变或减小),分析主要原因(用文字叙述)水形成晶体时,每个水分子与4个水分子形成氢键,构成空间正四面体网状结构,水分子空间利用率低,密度反而减小
; A2D由液态形成晶体时密度减小(填增大,不变或减小),分析主要原因(用文字叙述)水形成晶体时,每个水分子与4个水分子形成氢键,构成空间正四面体网状结构,水分子空间利用率低,密度反而减小查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 16O2和17O2都是氧的同素异形体 | |
| B. | 金属氧化物都是碱性氧化物 | |
| C. | 烟和雾可发生丁达尔现象,都属于胶体 | |
| D. | 合成纤维和光导纤维都是无机非金属材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5.6g铁粉与硝酸反应失去电子数一定为0.3×6.02×1023 | |
| B. | 反应MgCl2(l)=Mg(l)+Cl2(g)的△H<0、△S>0,故任何温度下都能自发进行 | |
| C. | 电解精炼铜过程中,电路中每通过1mol电子,阳极溶解铜32g | |
| D. | 0.1mol/LNa2SO3溶液中:c(OH-)-c(H+)=2c(H2SO3)+c(HSO3-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
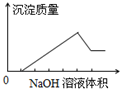 在某无色溶液中缓慢地滴入NaOH溶液直至过量,产生沉淀的质量与加入NaOH溶液体积的关系如图所示,由此确定,原溶液中含有的离子可能是( )
在某无色溶液中缓慢地滴入NaOH溶液直至过量,产生沉淀的质量与加入NaOH溶液体积的关系如图所示,由此确定,原溶液中含有的离子可能是( )| A. | Mg2+、Al3+、Fe3+ | B. | H+、Mg2+、Al3+ | C. | H+、Ba2+、Al3+ | D. | Na+、Mg2+、Al3+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com