
( 16分)下图表示几种无机物之间的转化关系.其中A 、B 均为黑色粉末,B为非金属单质,C 为无色无毒气体,D为金属单质,E 是红棕色气体,G 是具有漂白性的气体,H 的水溶液呈蓝色.
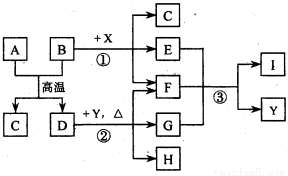
请回答下列问题:
(l)A的化学式是_____________,C 的电子式是_______________,Y 的名称是_______________.
(2)反应① 的化学方程式为______________________________________.
(3)实验室测定气体E 的相对分子质量时,得到的实验值总是比理论值偏大,其原因是(用化学方程式表示)_______________ _____________________.
(4)用石墨作电极电解H 的水溶液,电解总反应的离子方程式是____________ ______.
(5)推测反应③ 的还原产物可能是______________________.
(6)19.2 g的D与足量的一定浓度X的溶液反应,将所得的气体与 LO2(标准状况下)混合,恰好能被水完全吸收.
科目:高中化学 来源:2014-2015学年广东高考佛山市高三二模理综化学试卷(解析版) 题型:实验题
地下水中硝酸盐造成的氮污染已成为一个世界性的环境问题,某课题组利用Fe粉和酸性KNO3溶液反应模拟地下水脱氮过程,理想的脱氮原理为:4Fe + NO3- + 10H+ = 4Fe2+ + NH4+ + 3H2O。
(1)研究发现:随着KNO3溶液酸性的减弱,对应还原产物中氮元素的化合价越低。课题组用酸性弱的KNO3溶液进行实验,没有观察到气体生成,则该条件下KNO3的还原产物可能是 (化学式)。
(2)实验发现:反应一段时间后,反应体系中NH4+的浓度在增大,Fe2+的浓度却没有增大,可能的原因是 。
a.生成的Fe2+水解 b.Fe2+被氧化生成Fe3+ c.Fe2+被还原成Fe
(3)该课题组拟利用上述脱氮反应研究不同自变量对反应速率的影响。
可能用到的试剂和仪器:粗颗粒Fe粉、细颗粒Fe粉、2.0mol/L KNO3、0.1 mol/L H2SO4、蒸馏水、不同温度的恒温水浴、托盘天平、秒表、离子色谱仪等。
①设计实验方案:在不同的自变量(温度、铁粉颗粒的大小)时,测定 (要求所测得的数据能直接体现反应速率大小)。
②参照下表格式,拟定实验表格,完整体现实验方案(列出所选试剂体积、需记录的待测物理量和所拟定的数据:数据用字母表示)。
【提示】离子色谱仪能跟踪测定溶液中的c(NO3-)
物理量 实验序号 | V(2.0mol/L KNO3)/ mL | …… | |
1 | a | …… | |
2 | a | …… | |
3 | a | …… |
③进一步的研究表明:将铁粉和活性炭同时加入上述KNO3溶液中,可以明显提高脱氮速率,其原因是 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年重庆市高三下学期第一次月考理综化学试卷(解析版) 题型:选择题
关于10 mL 0.1 mol·L-1的NH3·H2O溶液,下列说法正确的是
A.25℃时,若溶液的pH=11,则Kb(NH3·H2O)=1×10-6
B.向溶液中加入少量CH3COONa固体,溶液中 的值变小
的值变小
C.向溶液中加入10 mL 0.1 mol·L-1盐酸,所得溶液中离子浓度大小顺序为:c(NH4+)>(Cl-)>c(H+)>c(OH-)
D.向溶液中加入5 mL 0.1 mol·L-1盐酸,所得溶液中离子的浓度一定符合:c(NH4+) + c(H+) = c(Cl-) + c(OH-)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年天津市高三四月考化学试卷(解析版) 题型:简答题
(14分)一定温度下,在恒容密闭容器中充入2molNO2与1molO2发生反应如下:
4NO2(g)+O2(g)  2N2O5(g)
2N2O5(g)
(1)已知平衡常数K350℃<K300℃,则该反应是_________反应(填“吸热”或“放热”);常温下,该反应能逆向自发进行,原因是_______________________________________。
(2)下列有关该反应的说法正确的是___________。
A.扩大容器体积,平衡向逆反应方向移动,混合气体颜色变深
B.恒温恒容下,再充入2molNO2和1molO2,再次达到平衡时NO2转化率增大
C.恒温恒容下,当容器内的密度不再改变,则反应达到平衡状态
D.若该反应的平衡常数增大,则一定是降低了温度
(3)氮的化合物种类较多,如NH3、NO、NO2、HNO3、硝酸盐等。
①亚硝酸是一种弱酸,能证明亚硝酸是弱电解质的是__________。
A.常温下,亚硝酸钠溶液的pH>7
B.亚硝酸能和NaOH发生中和反应
C.用亚硝 酸 溶液做导电性实验,灯泡很暗
D.常温下,将pH=3的亚硝酸溶液稀释10倍 ,pH<4
②根据酸碱质子理论,凡是能给出质子的分子或离子都是酸,凡是能结合质子的分子或离子都是碱。按照这个理论,下列微粒属于两性物质的是___________。
a.H2O
b.NO2-
c.H2NCH2COOH
d.H2PO4-
e.H2S
③氮同主族磷元素形成的Na2HPO4溶液显碱性,若向溶液中加入足量的CaCl2溶液,溶液则显酸性,其原因是___________________________________________(用离子方程式表示)。
(4)X、Y、Z、W分别是HNO3、NH4NO3、NaOH、NaNO2四种强电解质中的一种。下表是常温下浓度均为0.01 mol·L-1的X、Y、Z、W溶液的pH。
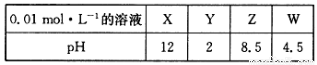

将X、Y、Z各1mol·L-1同时溶于水中制得混合溶液,则混合溶液中各离子的浓度由大到小的顺序为 ________________________________________________。
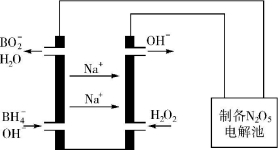 (5)N2O5是一种新型绿色硝化剂,其制备可以用硼氢化钠燃料电池作电源,采用电解法制备得到N2O5,工作原理如图。则硼氢化钠燃料电池的负极反应式为 。
(5)N2O5是一种新型绿色硝化剂,其制备可以用硼氢化钠燃料电池作电源,采用电解法制备得到N2O5,工作原理如图。则硼氢化钠燃料电池的负极反应式为 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年天津市高三四月考化学试卷(解析版) 题型:选择题
下列离子方程式正确的是
A.已知电离平衡常数:H2CO3>HClO>HCO3—,向NaClO溶液中通入少量CO2:2ClO—+CO2+H2O=2HClO+CO32—
B.向硫酸氢钠溶液中滴加Ba(OH)2至中性:H++SO42-+Ba2++ OH-=BaSO4↓+ H2O
C.Fe(NO3)3溶液中加入过量的HI溶液:2Fe3+ + 2I-=2Fe2+ + I2
D.硫氢根离子的电离方程式:HS-+H2O H3O++S2-[
H3O++S2-[
查看答案和解析>>
科目:高中化学 来源:2014-2015学年陕西省西安市高三下学期一模理综化学试卷(解析版) 题型:选择题
据测定,指示剂酚酞的结构简式可表示为下图:,下列说法不正确的是
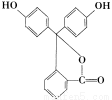
A.酚酞的分子式为C20H14O4
B.酚酞可与FeCl3溶液发生显色反应
C.1 mol酚酞与H2完全加成,最多可消耗10 mol H2
D.1 mol酚酞与NaOH溶液共热,最多可消耗3 mol NaOH
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东师大附中高三第七次模拟考试理综化学试卷(解析版) 题型:实验题
(19分)某课外小组对一些金属单质和化合物的性质进行研究。
(1)下表为“铝与氯化铜溶液反应”实验报告的一部分:
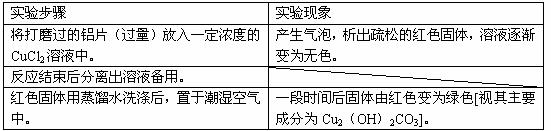
按反应类型写出实验中发生反应的化学方程式各一个(是离子反应的只写离子方程式)
置换反应____________________________________________________________;
化合反应____________________________________________________________。
(2)工业上可用铝与软锰矿(主要成分为MnO2)反应来冶炼金属锰。MnO2在H2O2分解反应中作催化剂。若将适量MnO2加入酸化后的H2O2溶液中,MnO2溶解产生Mn2+。该反应的离子方程式是 。
(3)某课外研究小组,用含有较多杂质的铜粉,通过不同的化学反应制取胆矾。其设计的实验过程为:
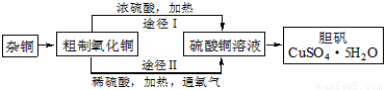
①铜中含有大量的有机物,可采用灼烧的方法除去有机物,灼烧时将瓷坩埚置于 上(用以下所给仪器的编号填入,下同),取用坩埚应使用 ,灼烧后的坩埚应放在 上,不能直接放在桌面上。
实验所用仪器:
a 蒸发皿
b 石棉网
c 泥三角
d 表面皿
e 坩埚钳
f 试管夹
②由粗制氧化铜通过两种途径制取胆矾,通过途径Ⅱ实现用粗制氧化铜制取胆矾,必须进行的实验操作步骤:酸溶、加热通氧气、过滤、 、冷却结晶、 、自然干燥,与途径Ⅰ相比,途径Ⅱ有明显的两个优点是: 、 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省枣庄市高三4月模拟考试化学试卷(解析版) 题型:选择题
T ℃时,将6 mol CO2和8 mol H2充入2 L密闭容器中,发生反应CO2(g)+3H2(g)  CH3OH(g)+H2O(g),容器中H2的物质的量随时间变化如图中实线所示。图中虚线表示仅改变某一反应条件时,H2的物质的量随时间的变化。下列说法正确的是
CH3OH(g)+H2O(g),容器中H2的物质的量随时间变化如图中实线所示。图中虚线表示仅改变某一反应条件时,H2的物质的量随时间的变化。下列说法正确的是
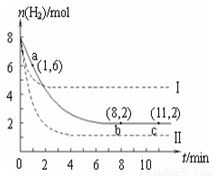
A.反应开始至a点时v(H2)=1 mol·L-1·min-1
B.若曲线Ⅰ对应的条件改变是升温,则该反应△H>0
C.曲线Ⅱ对应的条件改变是降低压强
D.T ℃时,该反应的化学平衡常数为0.125
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省长沙市高三5月一模化学试卷(解析版) 题型:简答题
(17分)汽车尾气中的主要污染物是NO和CO。为减轻大气污染,人们提出通过以下反应来处理汽车尾气:
(1)2NO(g)+2CO(g) 2CO2(g)+N2(g) △H=-746.5KJ/mol (条件为使用催化剂)
2CO2(g)+N2(g) △H=-746.5KJ/mol (条件为使用催化剂)
已知:2C (s)+O2(g) 2CO(g) △H=-221.0KJ/mol
2CO(g) △H=-221.0KJ/mol
C (s)+O2(g) CO2(g) △H=-393.5KJ/mol
CO2(g) △H=-393.5KJ/mol
则N2(g)+O2(g)=2NO(g) △H= kJ·mol-1。
(2)T℃下,在一容积不变的密闭容器中,通入一定量的NO和CO,用气体传感器测得不同时间NO和CO的浓度如下表
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
C(NO)10-4 mol/L | 10.0 | 4.50 | C1 | 1.50 | 1.00 | 1.00 |
C(NO)10-3 mol/L | 3.60 | 3.05 | C2 | 2.75 | 2.70 | 2.70 |
则c1合理的数值为 (填字母标号)。
A.4.20 B.4.00 C.3.50 D.2.50
(3)研究表明:在使用等质量催化剂时,增大催化剂的比表面积可提高化学反应速率。根据下表设计的实验测得混合气体中NO的浓度随时间t变化的趋势如下图所示:
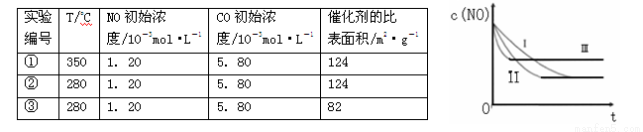
则曲线Ⅰ对应的实验编号依次为 。
(4)将不同物质的量的H2O(g)和CO(g)分别通入体积为2L的恒容密闭容器中,进行反应:H2O(g)+CO(g) CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
H2O | CO | CO | H2 | |||
① | 650 | 2 | 4 | 2.4 | 1.6 | 5 |
② | 900 | 1 | 2 | 1.6 | 0.4 | 3 |
③ | 900 | a | b | c | d | t |
①实验组①中以v(CO2)表示的反应速率为 ,温度升高时平衡常数会 (填“增大”、“减小”或“不变”)。
②若a=2,b=1,则c= ,达平衡时实验组②中H2O(g)和实验组③中CO的转化率的关系为
α2 (H2O) α3 (CO)(填“<”、“>”或“=”)。
(5)CO分析仪的传感器可测定汽车尾气是否符合排放标准,该分析仪的工作原理类似于燃料电池,其中电解质是氧化钇(Y2O3)和氧化锆(ZrO2)晶体,能传导O2-。
①则负极的电极反应式为________________。
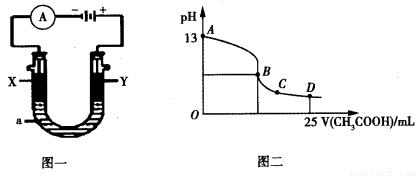
②以上述电池为电源,通过导线连接成图一。若X、Y为石墨,a为2L 0.1mol/L KCl溶液,写出电解总反应的离子方程式 。电解一段时间后,取25mL上述电解后的溶液,滴加0.4mol/L醋酸得到图二曲线(不考虑能量损失和气体溶于水,溶液体积变化忽略不计)。根据图二计算,上述电解过程中消耗一氧化碳的质量为__________g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com