
【题目】下列各组物质中,满足表中图示物质在一定条件下一步转化关系的组合有( )
序号 | X | Y | Z | W |
|
① | Si | Na2SiO3 | H2SiO3 | SiO2 | |
② | Na | NaOH | Na2CO3 | NaCl | |
③ | Cl2 | Ca(ClO)2 | HClO | HCl | |
④ | Fe | FeCl3 | FeCl2 | Fe(OH)2 |
A.②③B.①③④C.①④D.①②③
科目:高中化学 来源: 题型:
【题目】摩尔盐[(NH4)2Fe(SO4)26H2O]是一种浅绿色晶体,广泛应用于电镀工业。为探 究其分解产物,某学习小组利用如图所示装置进行实验。
(查阅资料)隔绝空气加热至500°C时,摩尔盐能完全分解,分解产物中有铁氧化物, 硫氧化物,氨气和水蒸气等。
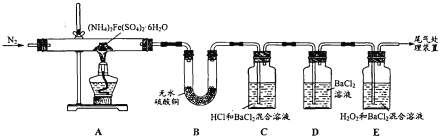
(1)对A装置加热前,先通一段时间N2的目的是_______。
(2)实验开始一段时间后,装置B中的现象为______。
(3)实验中观察到装置D始终无明显现象,装置C中和E中均产生白色沉淀。
①写出E中SO2与H2O2发生反应的化学方程式:_______。
②甲同学根据C中产生白色沉淀现象判断产物中一定含有SO3。请对甲同学的判断作出评价,并说明理由:_____。
(4)实验结束后,装置A中的固体变为红棕色,请补充完整检验该残留固体中是否含 FeO或Fe3O4的实验方案:取A中少量残留固体,加入稀硫酸使其完全溶解,向 溶液中滴加 ________,若观察到 ______,说明残留固体中不含FeO和Fe3O4。(提供的试剂有:NaOH溶液、氯水、硫氰化钾溶液、酸性高锰酸钾溶液)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高锰酸钾、高铬酸是一种典型的强氧化剂。完成下列填空:
(1)某一反应体系有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3、H2O、H2O2 已知该反应中H2O2只发生如下过程:H2O2→O2
①该反应中的还原剂是_____________。
②该反应中,发生还原反应的过程是____________→__________。
③写出该反应的化学方程式_______________________。
(2)在用KMnO4酸性溶液处理Cu2S和CuS的混合物时,发生的反应如下:
①MnO4-+Cu2S+H+→Cu2++SO2↑+Mn2++H2O(未配平)
②MnO4-+CuS+H+→Cu2++SO2↑+Mn2++H2O(未配平)
下列关于反应①的说法中正确的是______________(填字母序号)。
a.被氧化的元素是Cu和S
b.氧化剂与还原剂的物质的量之比为8∶5
c.生成2.24 L(标况下)SO2,反应转移电子的物质的量是0.8 mol
d.还原性的强弱关系是:Mn2+>Cu2S
(3)在稀硫酸中,![]() 和H2O2也能发生氧化还原反应。
和H2O2也能发生氧化还原反应。
已知:2KMnO4+7H2O2+3H2SO4===K2SO4+2MnSO4+6O2↑+10H2O,则被2 mol KMnO4氧化的H2O2是____________mol。
(4)高锰酸钾溶液与硫化亚铁固体有如下反应:
10FeS+6KMnO4+24H2SO4===3K2SO4+6MnSO4+5Fe2(SO4)3+10S+24H2O
若上述反应前后固体的质量减少了2.8 g,则硫元素与KMnO4之间发生电子转移的数目为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是由常见元素组成的一些单质及其化合物之间的转化关系图。各方框中的字母表示一种反应物或生成物(部分物质,反应条件已经略去)。其中A、B、D在常温下均为无色无味的气体,C是能使湿润的红色石蕊试纸变蓝的气体,M是最常见的无色液体。
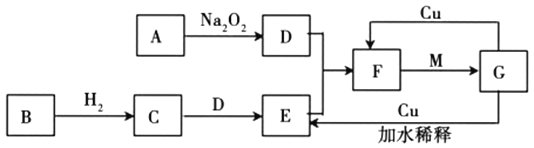
(1)写出![]() 的化学方程式:_______________________。
的化学方程式:_______________________。
(2)实验室常用加热两种固体混合物的方法制备物质C,其化学方程式为_________,干燥C常用_______________(填写试剂名称)。
(3)E物质遇到D物质时,会观察到_______________________现象,若用排水法收集F,则最终集气瓶中收集到的气体为____________________(写化学式)。
(4)写出![]() 的离子反应方程式_________________________。
的离子反应方程式_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今年是门捷列夫发现元素周期律150周年。下表是元素周期表的一部分,W、X、Y、Z为短周期主族元素,W与X的最高化合价之和为8。下列说法错误的是

A. 原子半径:W<X
B. 常温常压下,Y单质为固态
C. 气态氢化物热稳定性:Z<W
D. X的最高价氧化物的水化物是强碱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对各电解质溶液的分析正确的是( )
A.硫酸铁溶液中能大量共存的离子:K+、Na+、NO3-、CO32-
B.Ca(HCO3)2溶液与过量NaOH溶液反应:HCO3-+Ca2++OH-=CaCO3↓+H2O
C.0.1molL﹣1Na2S溶液中存在:c(OH-)=c(H+)+c(HS﹣)+2c(H2S)
D.NH4HSO4溶液呈酸性的主要原因是:NH4++H2O![]() NH3H2O+H+
NH3H2O+H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质(均为中学化学常见物质)转化关系图中,D为红棕色粉末(反应条件及部分反应物、产物未全部说明),B、C、E为常见单质,A、D为氧化物。
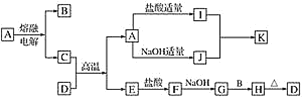
根据图示转化关系填写下列空白:
(1)写出下列物质的化学式A________,B________,G________。
(2)C与D的混合物通常称__________(填名称)。
(3)写出下列化学方程式或离子方程式
①I+J→K________________(离子方程式)。
②G+B→H________________(化学方程式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.将FeCl3溶液和Fe2(SO4)3溶液分别加热、蒸干、灼烧,所得固体成分相同
B.水解反应NH4++H2O![]() NH3H2O+H+达到平衡后,升高温度平衡逆向移动
NH3H2O+H+达到平衡后,升高温度平衡逆向移动
C.CH3COONa溶液中加入CH3COOH能促进CH3COO-水解
D.常温下,浓度均为0.1molL-1 NaCN和HCN混合液的pH=9,则c(HCN)>c(Na+)>c(CN﹣)>c(OH﹣)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式硫酸铝[(1x)Al2(SO4)3·xAl(OH)3]溶液可用于烟气脱硫。实验室用粉煤灰(主要含Al2O3、SiO2等)制备碱式硫酸铝溶液,实验流程如下:
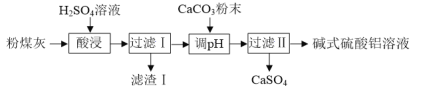
已知“调pH”的反应为:(2x)Al2(SO4)3+3xCaCO3+3xH2O=2[(1x)Al2(SO4)3·xAl(OH)3]+3xCaSO4↓+3xCO2↑
(1)“酸浸”时反应的化学方程式为____。
(2)“酸浸”时适当增大H2SO4溶液浓度的目的是____,能达到相同目的的方法还有____(任写一种)。
(3)“酸浸”时应控制H2SO4溶液的用量,H2SO4溶液用量不能过量太多的原因是____。
(4)通过测定碱式硫酸铝溶液中相关离子的浓度确定x的值,测定方法如下:
①取碱式硫酸铝溶液25.00 mL,加入盐酸酸化的过量BaCl2溶液充分反应,静置后过滤、洗涤,干燥至恒重,得固体2.3300 g。
②取碱式硫酸铝溶液2.50 mL,加入0.1000 mol·L1 EDTA标准溶液25.00 mL,调节溶液pH约为4.2,煮沸,冷却后用0.08000 mol·L1 CuSO4标准溶液滴定过量的EDTA至终点,消耗CuSO4标准溶液20.00 mL(已知Al3+、Cu2+与EDTA反应的化学计量比均为1∶1)。
计算(1x)Al2(SO4)3·xAl(OH)3中的x值(写出计算过程)____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com