
�����£���Cl2����ͨ��һ������ˮ�������ͣ�Ȼ�������ñ�����ˮ����μ���0.1mol��L-1������������Һ������������pH�仯��ͼ��ʾ�������й�������ȷ����

A������֮ǰ��������Ӧ�����ӷ���ʽΪCl2+H2O=2H++Cl��+ClO��
B��������ʾ��Һ����c(Na+)= c(HClO)+2c(ClO-)
C��ʵ���������Һ��pH������pH��ֽ���
D�����ߵ���ʼ��ˮ�ĵ���̶����
B
��������
���������A������֮ǰ������Cl2��H2O��Ӧ����HCl��HClO�ķ�Ӧ��HClOΪ���ᣬ���ܲ�����ӣ�����B���۵���Һ�����ԣ���c��H+��=c��OH-�������ݵ���غ��c��H+��+c��Na+��=c��Cl-��+c��Cl0-��+c��OH-��������c��Na+��=c��Cl-��+c��ClO-�������������غ��c��Cl-��=c��ClO-��+c��HClO��������c��Na+��=c��HClO��+2c��ClO-������ȷ��C����Ϊ��ˮ�к���HClO������Ư���ԣ�����ʵ���������Һ��pH������pH��ֽ���������D��Cl2��NaOHǡ�÷�Ӧʱˮ�ĵ���̶������
���㣺���⿼��Cl2�����ʡ�ͼ��ķ�����pH��ֽ��ʹ�á�����Ũ�ȱȽϡ�ˮ�ĵ��롣



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ���Ͽ�Ƭ | ||
| ���� | �۵�/�� | �е�/�� |
| SiCl4 | -70 | 57.6 |
| TiCl4 | -25 | 136.5 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A���٢� | B���ڢ� | C���٢� | D���ܢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 �����£���Cl2����ͨ��һ������ˮ�������ͣ�Ȼ�������ñ�����ˮ����μ���0.1mol?L-1������������Һ������������pH�仯��ͼ��ʾ�������й�������ȷ���ǣ�������
�����£���Cl2����ͨ��һ������ˮ�������ͣ�Ȼ�������ñ�����ˮ����μ���0.1mol?L-1������������Һ������������pH�仯��ͼ��ʾ�������й�������ȷ���ǣ�������| A���ڵ�֮ǰ��������Ӧ�����ӷ���ʽΪ��Cl2+H2O=2H++Cl-+ClO- | B���۵���ʾ��Һ�У�c��Na+��=c��HClO��+2c��ClO-�� | C��ʵ���������Һ��pH������pH��ֽ��� | D�����ߵ���ʼ��ˮ�ĵ���̶���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
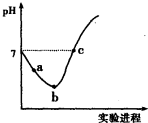 �����£���Cl2����ͨ��ˮ�������ͣ�Ȼ�������ñ�����ˮ�еμ�0.1mol?L-1��NaOH��Һ������ʵ���������Һ��pH�仯������ͼ��ʾ������������ȷ���ǣ�������
�����£���Cl2����ͨ��ˮ�������ͣ�Ȼ�������ñ�����ˮ�еμ�0.1mol?L-1��NaOH��Һ������ʵ���������Һ��pH�仯������ͼ��ʾ������������ȷ���ǣ�������| A��ʵ������п���pH��ֽ�ⶨ��Һ��pH | ||
| B��c����ʾ��Һ�У�c��Na+��=2c��ClO-��+c��HClO�� | ||
| C����a����ʾ��Һ��ͨ��SO2����Һ�����Ժ�Ư���Ծ���ǿ | ||
D����a�㵽b��Ĺ����У���Һ��
|
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com