
| A. | 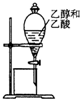 分离乙醇和乙酸混合溶液 | B. |  石油分馏 | ||
| C. |  电解精炼铜 | D. |  实验室用乙醇制取乙烯 |
分析 A.乙醇和乙酸互溶;
B.温度计不能插入到液面以下;
C.电解精炼铜,粗铜为阳极,纯铜为阴极;
D.温度计测量溶液温度,制取的乙烯中含有乙醇蒸气.
解答 解:A.乙醇和乙酸互溶,应用分液分离,故A错误;
B.温度计用于测量馏分的温度,应位于蒸馏烧瓶的支管口,不能插入到液面以下,故B错误;
C.电解精炼铜,粗铜为阳极,纯铜为阴极,电解质为铜盐溶液,故C正确;
D.温度计应该测量溶液温度而不是蒸气温度,乙醇易挥发,制取的乙烯中含有乙醇蒸气,所以收集乙烯前要出去乙醇,故D错误.
故选C.
点评 本题考查化学实验方案的评价,侧重于考查学生的综合运用化学知识的能力和评价能力,题目难度不大,注意把握相关物质的性质以及相关实验操作方法.


 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4LNO与11.2LO2混合,混合气体所含分子数为NA | |
| B. | 1molAl3+含有的核外电子数为10NA | |
| C. | 常温常压下,1mol氮气含有的原子总数为NA | |
| D. | 1L1mol/LFeCl3溶液全部制成胶体,其中含胶粒的数目小于NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无色溶液中:NH4+、Cu2+、CO32-、Cl- | |
| B. | 中性溶液中可能大量存在Na+、Ba2+、Cl-、NO3- | |
| C. | pH值为1的溶液:Na+、Al3+、CH3COO-、SO42- | |
| D. | 由水电离的c(H+)=1×10-13mol•L-1的溶液中:Mg2+、K+、HCO3-、Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
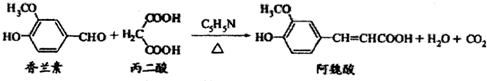
| A. | 1mol阿魏酸与足量溴水反应,消耗1molBr2 | |
| B. | 香兰素、阿魏酸均可与NaHCO3、NaOH溶液反应 | |
| C. | 通常条件下,香兰素、阿魏酸都能发生取代、加成、水解反应 | |
| D. | 香兰素与足量氢气完全反应后的产物,其1个分子中含有3个手性碳原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
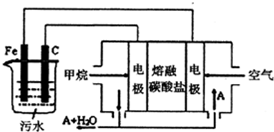 电浮选凝聚法是工业上采用的一种污水处理方法,通过电解污水最终生成的Fe(OH)3吸附污物而沉积下来,达到净水的目的.阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,除去浮渣层,即起到了浮选净化的作用,某科研小组利用上述原理,设计出如图所示的装置.
电浮选凝聚法是工业上采用的一种污水处理方法,通过电解污水最终生成的Fe(OH)3吸附污物而沉积下来,达到净水的目的.阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,除去浮渣层,即起到了浮选净化的作用,某科研小组利用上述原理,设计出如图所示的装置.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
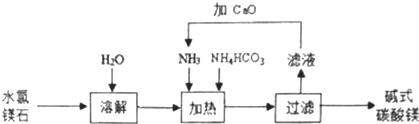
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若容器内压强不再变化,则说明该反应己达平衡 | |
| B. | 反应前H2S物质的量为2.5mol | |
| C. | CO和H2S达平衡后的转化率相同 | |
| D. | 若平衡后再加入CO,则正反应速率增大,逆反应速率减小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com