
【题目】某同学在试管中用一定量的铁片与足量的稀硫酸反应,得到产生氢气的体积随时间变化的图像(b).若铁的用量不变,改变一个反应条件,得到图像(a).则改变的条件可能是( ) 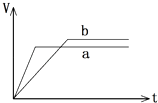
A.向试管中滴加少许硫酸铜溶液
B.在反应过程中对试管加热
C.用铁粉代替铁片
D.用98%的浓硫酸代替稀硫酸
 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】异戊二烯是重要的有机化工原料,其结构简式为CH2=C(CH3)CH=CH2 .
完成下列填空:
(1)化合物X与异戊二烯具有相同的分子式,与Br2/CCl4反应后得到3﹣甲基﹣1,1,2,2﹣四溴丁烷.X的结构简式为 .
(2)异戊二烯的一种制备方法如图所示:
A能发生的反应有 . (填反应类型)
B的结构简式为 .
(3)设计一条由异戊二烯制得有机合成中间体 ![]() 的合成路线. (合成路线常用的表示方式为:A
的合成路线. (合成路线常用的表示方式为:A ![]() B…
B… ![]() 目标产物)
目标产物)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】4A(s)+3B(g)═2C(g)+D(g),经2min后B的浓度减少0.6molL﹣1 . 对此反应速率的表示正确的是( )
A.用A表示的反应速率是0.4molL﹣1min﹣1
B.分别用B,C,D表示反应速率,其比值是3:2:1
C.在2min末的反应速率,用B表示是0.3molL﹣1min﹣1
D.在2min内的反应速率,用C表示是0.3molL﹣1min﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关氯的说法正确的是
A. Cl2具有很强的氧化性,在化学反应中只能作氧化剂
B. 1.12LCl2含有1.7NA个质子(NA表示阿伏加德罗常数)
C. 氯水放置数天后,酸性增强
D. 常温下干燥的Cl2能用钢瓶贮存,原因为Cl2在任何情况下均不与铁反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把由NaOH,AlCl3、MgCl2三种固体组成的混合物溶于足量的水中,有0.58g白色沉淀析出,向所得的浊液里,逐渐加入0.5mol/L的盐酸,加入盐酸的体积和生成沉淀的质量如图所示: 
(1)MgCl2的物质的量是mol;
(2)AlCl3的质量是g;
(3)混合物中NaOH的质量是g;
(4)P点所表示盐酸加入体积是mL.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关三氧化硫的说法中正确的是( )
A. SO3极易溶于水,且与水反应生成H2SO4
B. SO2、SO3均具有漂白性,均能使石蕊溶液变红色
C. SO3可与碱反应,但不与碱性氧化物反应
D. SO2在空气中易被氧化为SO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝镁合金因坚硬、轻巧、美观、洁净、易于加工而成为新型建筑装潢材料,主要用于制作窗框、卷帘门、防护拦等。下列性质中与这些用途无关的是
A. 不易生绣 B. 导电性好 C. 密度小 D. 强度高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组通过下面的实验一和实验二,探究某些化学理论.
(1)实验一:以反应2Fe3++2I﹣=2Fe2++I2为例, 探究该反应是否为可逆反应.
实验方法:在KI溶液中滴加3mLFeCl3溶液,将混合液均
匀分到甲、乙、丙三支试管中;往试管甲中滴加淀粉
溶液,往试管乙中滴加KSCN溶液.如图所示: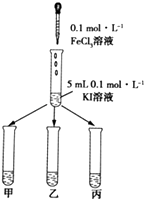
若试管甲中出现现象;
乙试管中出现现象,
则说明该反应为可逆反应.
(2)实验二:实验室制备CO2的反应.实验过程中的数据及相关信息如下表:
序号 | 反应温度/℃ | C(HCl)/molL﹣1 | V(HCl)/mL | 10g碳酸钙的形状 | t/min |
① | 20 | 2 | 10 | 块状 | t 1 |
② | 20 | 4 | 10 | 块状 | t 2 |
③ | 20 | 2 | 10 | 粉末 | t 3 |
④ | 40 | 2 | 10 | 粉末 | t 4 |
⑤ | 40 | 4 | 10 | 粉末 | t5 |
※t表示收集相同状况下体积都为a mL CO2所需的时间※
(i)由表格中的信息可知实验二的目的是探究
(ii)实验①和实验②是探究对该化学反应速率的影响,分析表格中的信息可知,对该化学反应速率的影响因素还有
(iii)收集a mL CO2所需的时间最少的实验是(填实验序号)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组同学模拟工业制碘的方法,探究ClO3﹣和I﹣的反应规律.实验操作及现象如表:
实验及试剂 | 编号 | 无色NaClO3 | 试管中 | 淀粉KI |
| 1 | 0.05 mL | 浅黄色 | 无色 |
2 | 0.20 mL | 深黄色 | 无色 | |
3 | 0.25 mL | 浅黄色 | 蓝色 | |
4 | 0.30 mL | 无色 | 蓝色 |
(1)取实验2后的溶液,进行如图实验: 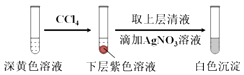
经检验,上述白色沉淀是AgCl.写出加入0.20mL NaClO3后,溶液中ClO3﹣和I﹣发生反应的离子方程式: .
(2)查阅资料:一定条件下,I﹣和I2都可以被氧化成IO3﹣ .
作出假设:NaClO3溶液用量增加导致溶液褪色的原因是过量的NaClO3溶液与(1)
中的反应产物继续反应,同时生成Cl2 .
进行实验:
①取少量实验4中的无色溶液进行如图实验,进一步佐证其中含有IO3﹣ . 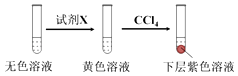
其中试剂X可以是(填字母序号).
a.碘水b.KMnO4溶液c.NaHSO3溶液
②有同学提出,仅通过湿润淀粉KI试纸变蓝的现象不能说明生成Cl2 , 便补充了如下实验:将实验4中的湿润淀粉KI试纸替换为湿润的淀粉试纸,再滴加0.30mL 1.33molL﹣1NaClO3溶液后,发现湿润的淀粉试纸没有明显变化.进行以上对比实验的目的是 , 进一步佐证实验4中生成了Cl2 . 获得结论:NaClO3溶液用量增加导致溶液褪色的原因是(用离子方程式表示).
(3)小组同学继续实验,通过改变实验4中硫酸溶液的用量,获得如表实验结果:
编号 | 6.0 molL﹣1 H2SO4溶液用量 | 试管中溶液颜色 | 淀粉KI试纸颜色 |
5 | 0.25 mL | 浅黄色 | 无色 |
6 | 0.85 mL | 无色 | 蓝色 |
①对比实验4和5,可以获得的结论是 .
②用离子方程式解释实验6的现象: .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com