
��ȥ���ʺ��ˮú����Ҫ��H2��CO��������ĺϳɼ״���ԭ������
��1������ˮú�������������·�Ӧ����C(s)+CO2(g)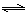 2CO(g)
��H1��
2CO(g)
��H1��
��CO(g)+H2O(g)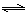 H2(g)+CO2(g)
��H2����C(s)+H2O(g)
H2(g)+CO2(g)
��H2����C(s)+H2O(g)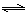 CO(g)+H2(g)
��H3��
CO(g)+H2(g)
��H3��
������Ӧ��H3���H1����H2֮��Ĺ�ϵΪ ��
��2����CH4ת����CO����ҵ�ϳ����ô�ת���������䷴Ӧԭ��Ϊ��2CH4(g)��3O2(g) 4CO(g)��4H2O(g)
��H=��1038kJ/mol����ҵ��Ҫѡ����ʵĴ������ֱ��X��Y��Z���ִ�����������ʵ�飨����������ͬ����
4CO(g)��4H2O(g)
��H=��1038kJ/mol����ҵ��Ҫѡ����ʵĴ������ֱ��X��Y��Z���ִ�����������ʵ�飨����������ͬ����
��X��750��ʱ��Ч����ߣ���ʹ����Ӧ���ʼӿ�Լ3��105����
��Y��600��ʱ��Ч����ߣ���ʹ����Ӧ���ʼӿ�Լ3��105����
��Z��440��ʱ��Ч����ߣ���ʹ�淴Ӧ���ʼӿ�Լ1��106����
����������Ϣ������Ϊ��������Ӧ��ѡ������˴����� ���X����Y����Z������ѡ��������� ��
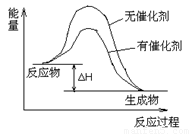
��3�����ڴ���У�������2���з�Ӧ���д�����������������·�Ӧ��������ϵ�����仯ʾ��ͼ�������б�Ҫ��ע��
��4���ϳ����ϳɼ״�����Ҫ��Ӧ�ǣ�2H2(g)+CO(g) CH3OH(g)
��H=��90.8kJ��mol��1��T���´˷�Ӧ��ƽ�ⳣ��Ϊ160��
CH3OH(g)
��H=��90.8kJ��mol��1��T���´˷�Ӧ��ƽ�ⳣ��Ϊ160��
���¶��£����ܱ������п�ʼֻ����CO��H2����Ӧ10min���ø���ֵ�Ũ�����£�
|
���� |
H2 |
CO |
CH3OH |
|
Ũ��/��mol��L��1�� |
0.20 |
0.10 |
0.40 |
�ٸ�ʱ�����ƽ����Ӧ����v(H2)= ��
�ڱȽϴ�ʱ�����淴Ӧ���ʵĴ�С��v(��) v (��)���������������������
��5�����������У��ϳ���Ҫ����ѭ������Ŀ���� ��
��16�֣�
��1����H3=��H1+��H2��2�֣�
��2��Z��2�֣� ��Ч�ʸ��һ����¶ȵͣ����ܣ�������Ըߡ��ٶȿ죬��Ӧ�¶ȵͣ���3�֣�
��3����ͼ���£�3�֣���
��4����0.080 mol��L��1��min��1 ��2�֣� �ڣ���2�֣�
��5�����ԭ�������ʣ�����߲���������Ҳ�ɣ���2�֣�
��������
�����������1���۲�3���Ȼ�ѧ����ʽ�����֢�+��=�ۣ����ݸ�˹���ɣ���H3=��H1+��H2����2������Ӧ�Ƿ��ȷ�Ӧ�������¶�ƽ�����淴Ӧ�����ƶ��������ڼ���ת��ΪCO�����ѡ��Z��������Ϊ��Ч�ʸ��һ����¶ȵͣ����ܣ�������Ըߡ��ٶȿ죬��Ӧ�¶ȵͣ�����3����ͼҪ�㣺��Ӧ��������������������������������ʱ�����淴Ӧ�Ļ�ܽϸߣ������ܽ��������淴Ӧ�Ļ�ܣ����ʱ䡢��Ӧ������������������Ӱ�죬�д���ʱ�����淴Ӧ�Ļ�ܽϵͣ���ע��Ӧ��������H���������д�������4�������ö���ʽ��v(CH3OH)������ϵ��֮�ص�������֮����v(H2)����v(CH3OH)=��c(CH3OH)/��t=(0.40��0)mol/L��10min=0.040mol/(L•min)������v(H2)/v(CH3OH)=2/1����v(H2)=2v(CH3OH)= 0.080mol/(L•min)��������λ��Ч���֣��ڴ�ʱc(CH3OH)/[ c2(H2)•c(CO)]=0.40/[0.202��0.10]=100������100<K=160��Ϊ���ܴﵽ���¶��µ�ƽ�ⳣ����˵���÷�Ӧ������Ӧ������У���v(��)> v(��)����5���ϳ���ѭ�����õ�Ŀ�������ԭ��������(����߲���������Ҳ��)��
���㣺���黯ѧ��Ӧԭ�����漰��˹���ɡ�������ѡ����ԭ��������ʱ��ϵ�����仯ʾ��ͼ��ƽ����Ӧ���ʵļ��㡢��ѧƽ�ⳣ����Ӧ�á�ѭ�����úϳ�����Ŀ�ĵȡ�


 ȫ�ų��100��ϵ�д�
ȫ�ų��100��ϵ�д� Ӣ�ŵ��ϵ�д�
Ӣ�ŵ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ���㶫ʡ������2012�����ѧҵˮƽ���Ի�ѧ���� ���ͣ�022
��ȥˮ�������ˮú����Ҫ��H2��CO��CO2��������H2S��CH4��������ȥH2S�ɲ��ô���Ǵ�ת����������CH4ת����CO���õ�CO��CO2��H2�Ļ�����壬������ĺϳɼ״�ԭ������
(1)��ˮú������Ҫ��ѧ��Ӧ����ʽΪ��C(s)��H2O(g) CO(g)��H2(g)���˷�Ӧ�����ȷ�Ӧ��
CO(g)��H2(g)���˷�Ӧ�����ȷ�Ӧ��
�ٴ˷�Ӧ�Ļ�ѧƽ�ⳣ������ʽΪ________��
������������̼��ת���ʵĴ�ʩ��________��
A������C(s)
B������H2O(g)
C�������¶�
D������ѹǿ
(2)��CH4ת����CO����ҵ�ϳ����ô�ת���������䷴Ӧԭ��Ϊ��
CH4(g)��![]() O2(g)
O2(g)![]() CO(g)��2H2O(g)����H����519 kJ/mol����ҵ��Ҫѡ����ʵĴ������ֱ��X��Y��Z���ִ�����������ʵ��(����������ͬ)
CO(g)��2H2O(g)����H����519 kJ/mol����ҵ��Ҫѡ����ʵĴ������ֱ��X��Y��Z���ִ�����������ʵ��(����������ͬ)
��X��750��ʱ��Ч����ߣ���ʹ����Ӧ���ʼӿ�Լ3��105����
��Y��600��ʱ��Ч����ߣ���ʹ����Ӧ���ʼӿ�Լ3��105����
��Z��440��ʱ��Ч����ߣ���ʹ�淴Ӧ���ʼӿ�Լ1��106����
����������Ϣ������Ϊ��������Ӧ��ѡ������˴�����________(�X����Y����Z��)��ѡ���������________��
(3)��������ͼ�У�����������Ӧ���д�����������������·�Ӧ��������ϵ�����仯ʾ��ͼ�������б�Ҫ��ע��
(4)�ϳ����ϳɼ״�����Ҫ��Ӧ�ǣ�
2H2(g)��CO(g)![]() CH3OH(g)����H����90.8 kJ��mol��1��T���´˷�Ӧ��ƽ�ⳣ��Ϊ160�����¶��£����ܱ������п�ʼֻ����CO��H2����Ӧ10 min���ø���ֵ�Ũ�����£�
CH3OH(g)����H����90.8 kJ��mol��1��T���´˷�Ӧ��ƽ�ⳣ��Ϊ160�����¶��£����ܱ������п�ʼֻ����CO��H2����Ӧ10 min���ø���ֵ�Ũ�����£�
![]()
�ٸ�ʱ����ڷ�Ӧ����v(H2)��________mol��L��1��min��1��
�ڱȽϴ�ʱ�����淴Ӧ���ʵĴ�С��v��________v��(�����������������)
(5)���������У��ϳ���Ҫ����ѭ������Ŀ����________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��ɽ��ʡʵ����ѧ2012�������һ������Կ��Ի�ѧ���� ���ͣ�022
��ˮú����ת���ɺϳ�����Ȼ��ϳɸ�����Ʒ��ʯ����Ʒ�ǻ����ļ�Ϊ��Ҫ������ȥˮ�������ˮú����Ҫ��H2��CO��CO2��������H2S��CH4��������ȥH2S�ɲ��ô���Ǵ�ת����������CH4ת����CO���õ�CO��CO2��H2�Ļ�����壬������ĺϳɼ״�ԭ������
(1)��ˮú������Ҫ��ѧ��Ӧ����ʽΪ��C(s)��H2O(g) CO(g)��H2(g)���˷�Ӧ�����ȷ�Ӧ��
CO(g)��H2(g)���˷�Ӧ�����ȷ�Ӧ��
�ٴ˷�Ӧ�Ļ�ѧƽ�ⳣ������ʽΪ________��
������������̼��ת���ʵĴ�ʩ��________��
A������C(s)
B������H2O(g)
C�������¶�
D������ѹǿ
(2)��CH4ת����CO����ҵ�ϳ����ô�ת���������䷴Ӧԭ��Ϊ��
CH4(g)��3/2O2(g)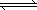 CO(g)��2H2O(g)����H����519 kJ/mol����ҵ��Ҫѡ����ʵĴ������ֱ��X��Y��Z���ִ�����������ʵ��(����������ͬ)
CO(g)��2H2O(g)����H����519 kJ/mol����ҵ��Ҫѡ����ʵĴ������ֱ��X��Y��Z���ִ�����������ʵ��(����������ͬ)
��X��750��ʱ��Ч����ߣ���ʹ����Ӧ���ʼӿ�Լ3��105����
��Y��600��ʱ��Ч����ߣ���ʹ����Ӧ���ʼӿ�Լ3��105����
��Z��440��ʱ��Ч����ߣ���ʹ�淴Ӧ���ʼӿ�Լ1��106����
��֪����������Ϣ������Ϊ��������Ӧ��ѡ������˴�����________(�X����Y����Z��)��ѡ���������________��
(3)�ϳ�����ѹ�����º����״��ϳ������ڴ��������£����м״��ϳɣ���Ҫ��Ӧ���£�
2H2(g)��CO(g)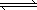 CH3OHg)����H����90.8 kJ��mol��1��T���´˷�Ӧ��ƽ�ⳣ��Ϊ160�����¶��£����ܱ������п�ʼֻ����CO��H2����Ӧ10 min���ø���ֵ�Ũ�����£�
CH3OHg)����H����90.8 kJ��mol��1��T���´˷�Ӧ��ƽ�ⳣ��Ϊ160�����¶��£����ܱ������п�ʼֻ����CO��H2����Ӧ10 min���ø���ֵ�Ũ�����£�
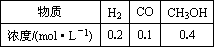
�ٸ�ʱ����ڷ�Ӧ����v(H2)��________mol��1��L��1��min��1��
�ڱȽϴ�ʱ�����淴Ӧ���ʵĴ�С��v��________v��(�����������������)
(4)���������У��ϳ���Ҫ����ѭ������Ŀ����________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2011-2012ѧ��ɽ��ʡ�{����һ������Կ��Ի�ѧ�Ծ� ���ͣ������
��15�֣���ˮú����ת���ɺϳ�����Ȼ��ϳɸ�����Ʒ��ʯ����Ʒ�ǻ����ļ�Ϊ��Ҫ������ȥˮ�������ˮú����Ҫ��H2��CO��CO2��������H2S��CH4��������ȥH2S�ɲ��ô���Ǵ�ת����������CH4ת����CO���õ�CO��CO2��H2�Ļ�����壬������ĺϳɼ״�ԭ������
��1����ˮú������Ҫ��ѧ��Ӧ����ʽΪ��C(s)+H2O(g) CO(g)+H2(g)���˷�Ӧ�����ȷ�Ӧ��
�ٴ˷�Ӧ�Ļ�ѧƽ�ⳣ������ʽΪ ��
������������̼��ת���ʵĴ�ʩ�� ��
A������C��s�� B������H2O��g�� C�������¶� D������ѹǿ
��2����CH4ת����CO����ҵ�ϳ����ô�ת���������䷴Ӧԭ��Ϊ��
 CH4(g)+3/2O2(g)
CO(g)+2H2O(g) ��H=-519kJ/mol����ҵ��Ҫѡ����ʵĴ������ֱ��X��Y��Z���ִ�����������ʵ�飨����������ͬ��
CH4(g)+3/2O2(g)
CO(g)+2H2O(g) ��H=-519kJ/mol����ҵ��Ҫѡ����ʵĴ������ֱ��X��Y��Z���ִ�����������ʵ�飨����������ͬ��
��X��750��ʱ��Ч����ߣ���ʹ����Ӧ���ʼӿ�Լ3��105����
��Y��600��ʱ��Ч����ߣ���ʹ����Ӧ���ʼӿ�Լ3��105����
��Z��440��ʱ��Ч����ߣ���ʹ�淴Ӧ���ʼӿ�Լ1��106����
��֪����������Ϣ������Ϊ��������Ӧ��ѡ������˴����� ���X����Y����Z������ѡ��������� ��
��3���ϳ�����ѹ�����º����״��ϳ������ڴ��������£����м״��ϳɣ���Ҫ��Ӧ���£�
 2H2(g)+CO(g)
CH3OHg); ��H=-90.8kJ��mol-1��T���´˷�Ӧ��ƽ�ⳣ��Ϊ160�����¶��£����ܱ������п�ʼֻ����CO��H2����Ӧ10min���ø���ֵ�Ũ�����£�
2H2(g)+CO(g)
CH3OHg); ��H=-90.8kJ��mol-1��T���´˷�Ӧ��ƽ�ⳣ��Ϊ160�����¶��£����ܱ������п�ʼֻ����CO��H2����Ӧ10min���ø���ֵ�Ũ�����£�
|
���� |
H2 |
CO |
CH3OH |
|
Ũ��/��mol��L-1�� |
0.2 |
0.1 |
0.4 |
�ٸ�ʱ����ڷ�Ӧ����v(H2)= mol-1��L-1��min-1��
�ڱȽϴ�ʱ�����淴Ӧ���ʵĴ�С��
 ���>������<����=����
���>������<����=����
��4�����������У��ϳ���Ҫ����ѭ������Ŀ���� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2012��ɽ��ʡʵ����ѧ�{����һ������Կ��Ի�ѧ�Ծ� ���ͣ������
��15�֣���ˮú����ת���ɺϳ�����Ȼ��ϳɸ�����Ʒ��ʯ����Ʒ�ǻ����ļ�Ϊ��Ҫ������ȥˮ�������ˮú����Ҫ��H2��CO��CO2��������H2S��CH4��������ȥH2S�ɲ��ô���Ǵ�ת����������CH4ת����CO���õ�CO��CO2��H2�Ļ�����壬������ĺϳɼ״�ԭ������
��1����ˮú������Ҫ��ѧ��Ӧ����ʽΪ��C(s)+H2O(g) CO(g)+H2(g)���˷�Ӧ�����ȷ�Ӧ��
�ٴ˷�Ӧ�Ļ�ѧƽ�ⳣ������ʽΪ ��
������������̼��ת���ʵĴ�ʩ�� ��
| A������C��s�� | B������H2O��g�� | C�������¶� | D������ѹǿ |

 CH4(g)+3/2O2(g) CO(g)+2H2O(g) ��H=-519kJ/mol����ҵ��Ҫѡ����ʵĴ������ֱ��X��Y��Z���ִ�����������ʵ�飨����������ͬ��
CH4(g)+3/2O2(g) CO(g)+2H2O(g) ��H=-519kJ/mol����ҵ��Ҫѡ����ʵĴ������ֱ��X��Y��Z���ִ�����������ʵ�飨����������ͬ�� 2H2(g)+CO(g) CH3OHg); ��H=-90.8kJ��mol-1��T���´˷�Ӧ��ƽ�ⳣ��Ϊ160�����¶��£����ܱ������п�ʼֻ����CO��H2����Ӧ10min���ø���ֵ�Ũ�����£�
2H2(g)+CO(g) CH3OHg); ��H=-90.8kJ��mol-1��T���´˷�Ӧ��ƽ�ⳣ��Ϊ160�����¶��£����ܱ������п�ʼֻ����CO��H2����Ӧ10min���ø���ֵ�Ũ�����£�| ���� | H2 | CO | CH3OH |
| Ũ��/��mol��L-1�� | 0.2 | 0.1 | 0.4 |
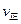
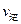 ���>������<����=����
���>������<����=�����鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com