
分析 (1)溶液是均匀的,取出的氢氧化钠溶液浓度等于原溶液的浓度,根据n=cV计算取出溶液中氢氧化钠的物质的量,再根据m=nM计算取出的溶液中氢氧化钠的质量;
(2)根据n=$\frac{V}{{V}_{m}}$可以计算该HCl气体的物质的量;根据c=$\frac{n}{V}$可以计算所配成的盐酸溶液的物质的量浓度;
(3)①根据ρ=$\frac{m}{V}$计算;
②根据n=$\frac{V}{{V}_{m}}$计算混合气体的物质的量,再根据M=$\frac{{m}_{总}}{{n}_{总}}$计算;
③设CO与CO2的物质的量分别为xmol、ymol,根据二者质量及物质的量列方程解答;
④根据(3)中的数据计算;
⑤结合④中数据,根据m=nM计算;
⑥结合④中的数据,根据质量分数定义计算;
⑦结合分子中含有含有氧原子数目计算.
解答 解:(1)溶液是均匀的,取出的100mL NaOH溶液浓度等于原溶液的浓度为1mol/L,
该100mL NaOH溶液中氢氧化钠的物质的量为0.1L×1mol/L=0.1L,故氢氧化钠的质量为0.1mol×40g/mol=4g,
故答案为:1;4;
标准状况下44.8LHCl气体的物质的量为:$\frac{44.8L}{22.4L/mol}$=2mol,
所配成的盐酸溶液的物质的量浓度为:$\frac{2mol}{0.5L}$=4mol/L,
故答案为:2mol;4mol/L.
(3)在标准状况下15g CO与CO2的混合气体,体积为11.2L,
①混合气体的密度=$\frac{15g}{11.2L}$=1.339g/L,
故答案为:1.339g/L;
②混合气体的物质的量=$\frac{11.2L}{22.4L/mol}$=0.5mol,混合气体平均摩尔质量=$\frac{15g}{0.5mol}$=30g/mol,
故答案为:30g/mol;
③设CO与CO2的物质的量分别为xmol、ymol,根据二者质量及物质的量,则:x+y=0.5、28x+44y=15,解得:x=$\frac{7}{16}$、y=$\frac{1}{16}$,故CO2和CO的体积之比是$\frac{1}{16}$mol:$\frac{7}{16}$mol=1:7,
故答案为:1:7;
④CO的体积分数=$\frac{7mol}{1mol+7mol}$=$\frac{7}{8}$=87.5%,
故答案为:87.5%;
⑤CO2和CO的质量之比是1mol×44g/mol:7mol×28g/mol=11:49,
故答案为:11:49;
⑥CO的质量分数是$\frac{7mol×28g/mol}{1mol×44g/mol+7mol×28g/mol}$×100%=81.7%,
故答案为:81.7%;
⑦混合气体中所含氧原子的物质的量是:$\frac{1}{16}$mol×2+$\frac{7}{16}$mol=$\frac{9}{16}$mol,
故答案为:$\frac{9}{16}$mol.
点评 本题考查了物质的量、物质的量浓度的计算,题目难度中等,试题知识点较多、计算量较大,充分考查学生的分析能力及化学计算能力,明确物质的量与物质的量浓度、摩尔质量等物理量之间的关系为解答关键.


科目:高中化学 来源: 题型:解答题
| 实验 方案 | 实验操作 | 实验 现象 | 结论 |
| 方案1 | 取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入无色酚酞试液 | 溶液变 成红色 | 白色物 质为 Na2O |
| 方案2 | ①取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入过量的CaCl2溶液 | 出现白 色沉淀 | |
| ②静置片刻,取上层清液于试管中,滴加无色酚酞试液 | 无明显 现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
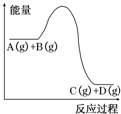
| A. | 加入催化剂时,该反应的反应热发生改变 | |
| B. | 升高温度,利于A的转化率增大 | |
| C. | 该反应的正反应为放热反应 | |
| D. | 增大压强,能够加快反应达到平衡状态的速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Q一定是氧化剂 | |
| B. | 当有1 mol O2生成时转移电子2 mol | |
| C. | Na2O2只作氧化剂 | |
| D. | Na2O2只作还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Na2SO4溶液中混有少量CuSO4的杂质可用适量的KOH除去 | |
| B. | Na2CO3固体中含有少量NaHCO3杂质可用加热的方法提纯 | |
| C. | Fe(NO3)3中混有少量Fe(NO3)2的杂质可加入适量的氯水除去 | |
| D. | 可以用分液的方法分离CCl4和水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 40mL 0.5mol•L-1 NaCl溶液 | B. | 10 mL 0.3 mol•L-1Na2SO4溶液 | ||
| C. | 50mL 0.4 mol•L-1 NaOH溶液 | D. | 20mL 0.15 mol•L-1 Na3PO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | O2完全转化为SO3 | |
| B. | SO2、O2、SO3同时存在 | |
| C. | SO2、O2与SO3的浓度不再随时间变化 | |
| D. | SO2、O2与SO3的物质的量之比为2:1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.6mol/L | B. | 2mol/L | C. | 2.8 mol/L | D. | 4 mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com