
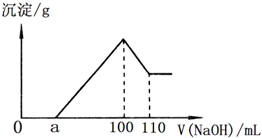
 准确称取22.7g某矿石样品(含Al2O3、Fe2O3和不溶于水和酸的杂质),放入盛有100mL某浓度的硫酸的烧杯中,充分反应后过滤,向滤液中加入10mol/L的NaOH溶液,产生的沉淀的质量m与加入NaOH溶液的体积V的关系如图所示.请回答:
准确称取22.7g某矿石样品(含Al2O3、Fe2O3和不溶于水和酸的杂质),放入盛有100mL某浓度的硫酸的烧杯中,充分反应后过滤,向滤液中加入10mol/L的NaOH溶液,产生的沉淀的质量m与加入NaOH溶液的体积V的关系如图所示.请回答:| 0.5mol |
| 0.1L |
| 17.6g |
| 160g/mol |
| 0.96mol |
| 10mol/L |


湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com