
| A. | 物质发生化学反应时都伴随着能量变化,伴随着能量变化的物质变化一定是化学变化 | |
| B. | 需要加热的化学反应一定是吸热反应,不需要加热就能进行的反应一定是放热反应 | |
| C. | 化学变化中的能量变化主要是由化学键变化引起的 | |
| D. | 因为石墨变成金刚石吸热,所以金刚石比石墨稳定 |
分析 A、化学反应的实质是旧化学键断裂和新化学键形成,过程中一定伴随能量变化,有些物理变化也伴随能量变化;
B.焓变与反应条件无关,放热反应也需要加热发生,吸热反应不需加热也可以发生;
C.化学变化中断键吸收能量,成键放出能量;
D.物质能量越高越活泼.
解答 解:A、物质的三态变化有能量变化,是物理变化,如灯泡发光,伴随着能量变化的物质变化不一定是化学变化,故A错误;
B.需要加热的化学反应不一定是吸热反应,如铝热剂需要加热才能发生,不需要加热就能进行的反应不一定是放热反应,如氢氧化钡晶体和氯化铵混合瞬间完成,发生的吸热反应,故B错误;
C.化学变化中断键吸收能量,成键放出能量,所以化学变化中的能量变化主要是由化学键的变化引起的,故C正确;
D.因为石墨变成金刚石吸热,金刚石能量高,石墨比金刚石稳定,故D错误;
故选C.
点评 本题考查了能量变化和化学反应、焓变与反应条件无关、焓变与反应物状态的关系、物质的能量越低越稳定,题目难度不大.


 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案科目:高中化学 来源: 题型:选择题
| A. | 等质量的硫蒸气和硫黄分别完全燃烧,后者放出的热量多 | |
| B. | 氢气的燃烧热为285.5 kJ/mol,则氢气燃烧的热化学方程式为:2H2(g)+O2(g)═2H2O(l)△H=-285.8 kJ/mol | |
| C. | Ba(OH)2•8H2O(s)+2NH4Cl(s)═=BaCl2(s)+2NH3(g)+10H2O(l)△H<0 | |
| D. | 已知中和热为57.3 kJ/mol,若将含0.5 mol H2SO4的浓溶液与含1 mol NaOH的溶液混合,放出的热量要大于57.3 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
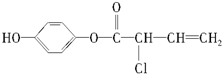 ,有关M的下列叙述中正确的是( )
,有关M的下列叙述中正确的是( )| A. | 可与H2反应,1 mol M最多消耗5 mol H2 | |
| B. | 可与浓溴水反应,1 mol M最多消耗4 mol Br2 | |
| C. | 可与NaOH溶液反应,1 mol M最多消耗4 mol NaOH | |
| D. | M不能使酸性高锰酸钾溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 甲 | 乙 | |
| 丙 | 丁 | 戊 |
| A. | 原子半径:甲<乙<丙 | B. | 金属性:甲<丙 | ||
| C. | 氢氧化物碱性:丙>丁>戊 | D. | 最外层电子数:甲<乙 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
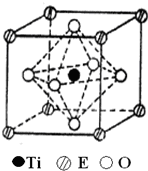 A、B、C、D、E五种元素都是前36号元素,原子序数依次增大,其相关信息如下表:
A、B、C、D、E五种元素都是前36号元素,原子序数依次增大,其相关信息如下表:| 元素 | 相关信息 |
| A | A的第一电离能低于同周期左右相邻元素 |
| B | B原子中成对电子数等于未成对电子数的2倍 |
| C | C原子p轨道和s轨道中的电子数相等,与非金属的原子结合时形成共价键 |
| D | D与A、B、C均不同周期,其一个单质分子中只有一个σ键 |
| E | E的原子序数比所处周期中未成对电子数最多的元素大3 |
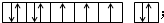 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com