

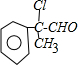
 ,与新制氢氧化铜反应生成B为
,与新制氢氧化铜反应生成B为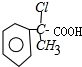 与乙醇酯化反应生成A为
与乙醇酯化反应生成A为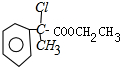 ,C与氢氧化钠的醇溶液发生消去反应生成F为
,C与氢氧化钠的醇溶液发生消去反应生成F为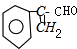 ,与银氨溶液反应,醛基被氧化成羧基,X是B的同系物.它比B少一个碳原子,所以X为
,与银氨溶液反应,醛基被氧化成羧基,X是B的同系物.它比B少一个碳原子,所以X为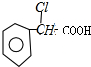 根据条件可写出结构简式;
根据条件可写出结构简式; ,与新制氢氧化铜反应生成B为
,与新制氢氧化铜反应生成B为 与乙醇酯化反应生成A为
与乙醇酯化反应生成A为 ,C与氢氧化钠的醇溶液发生消去反应生成F为
,C与氢氧化钠的醇溶液发生消去反应生成F为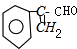 ,与银氨溶液反应,醛基被氧化成羧基,X是B的同系物.它比B少一个碳原子,所以X为
,与银氨溶液反应,醛基被氧化成羧基,X是B的同系物.它比B少一个碳原子,所以X为 根据条件可写出结构简式;
根据条件可写出结构简式; 转化为F
转化为F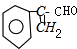 的反应类型为消去反应,故答案为:消去反应;
的反应类型为消去反应,故答案为:消去反应; 中官能团的为醛基,故答案为:醛基;
中官能团的为醛基,故答案为:醛基; ,故答案为:
,故答案为: ;
;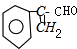 ,与银氨溶液反应,醛基被氧化成羧基,化学方程式为:
,与银氨溶液反应,醛基被氧化成羧基,化学方程式为: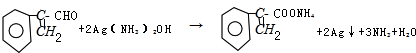 ,故答案为:
,故答案为: ;
; ,它的同分异构体中属于酯类且苯环上有两个相邻取代基的结构简式为:
,它的同分异构体中属于酯类且苯环上有两个相邻取代基的结构简式为: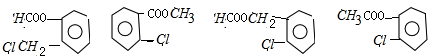 ,故答案为:
,故答案为: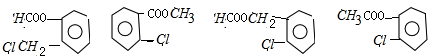 ;
;


 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案科目:高中化学 来源: 题型:
A、
| ||
B、
| ||
C、
| ||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NH4CNO和CO(NH2)2 |
| B、CuSO4?3H2O和CuSO4?5H2O |
C、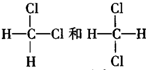 |
| D、H2O和D2O(重水) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在ABn分子中A原子的所有价电子都参与成键 |
| B、在ABn分子中A的相对原子质量应小于B的相对原子质量 |
| C、在ABn分子中每个共价键的键长都相等 |
| D、分子中不能含有H原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验步骤 | 预期现象和结论 |
步骤1:取少量吸收液于试管中,滴加3moL?L-1 H2SO4至溶液呈酸性,然后将所得溶液分置于A、B试管中. | / |
| 步骤2: | |
| 步骤3: |
查看答案和解析>>
科目:高中化学 来源: 题型:
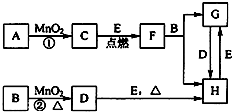 如图中所涉及的物质均为中学化学中的常见物质,其中C为单质,且为空气的主要成分之一;D为黄绿色气体;E为日常生活中应用最广泛的金属单质之一,其余为化合物.它们存在如图所示的转化关系,反应中生成的次要产物均已略去.
如图中所涉及的物质均为中学化学中的常见物质,其中C为单质,且为空气的主要成分之一;D为黄绿色气体;E为日常生活中应用最广泛的金属单质之一,其余为化合物.它们存在如图所示的转化关系,反应中生成的次要产物均已略去.查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com