
已知X、Y、Z、M均为中学常见单质或化合物,它们之间存在如图所示转化关系 (部分产物略去)。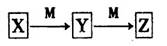
上述转化中X可能是下列物质中的
①S单质 ②AlCl3 ③NaOH ④NH3
A.1种 B.2种 C.3种 D.4种
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
下列说法不正确的是 ( )
A.PM 2.5的产生和成分比较复杂,但主要与人类活动有关
B.向氯乙烷中加入硝酸酸化的AgNO3溶液来检验Cl-
C.酒精可使蛋白质变性,故能消毒杀菌
D.塑化剂是一种化工塑料软化剂,可以大量添加到婴幼儿玩具中
查看答案和解析>>
科目:高中化学 来源: 题型:
硝酸铵是一种常用的化肥,其工业生产流程如下图,请回答下列问题。
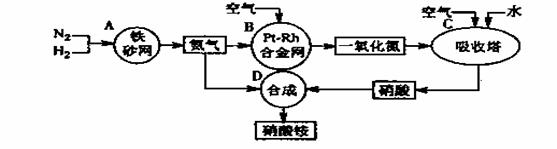
⑴写出反应容器B中发生反应的化学方程式: 。
⑵吸收塔C中通入空气的目的是 ;A、B、C、D四个反应容器中发生的反应,属于氧化还原反应的是 (填反应容器代号)。
⑶浓硝酸一般保存在棕色试剂瓶里,并放置在阴凉处,用化学方程式解释原因: 。
⑷金属铜与浓硝酸反应的离子方程式是 ,该反应中浓硝酸表现的性质是 。
查看答案和解析>>
科目:高中化学 来源: 题型:

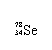
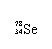
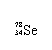 Se是人体必需的微量元素,下列有关 和 的说法正确的是
Se是人体必需的微量元素,下列有关 和 的说法正确的是
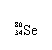
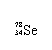
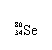
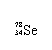 A. 和 互为同位素 B. 和 都含有34个中子
A. 和 互为同位素 B. 和 都含有34个中子
C. 和 分别含有44和46个质子 D. 和 含有相同的电子数
查看答案和解析>>
科目:高中化学 来源: 题型:
下表是周期表中的一部分,根据A—I在周期表中的位置,用元素符号或化学式回答下列问题:
|
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | A | |||||||
| 2 | B | D | G | |||||
| 3 | E | C | H | |||||
| 4 | F | I |
(1)写出相应元素符号:A: E: G: H: 。
(2)第ⅠA中碱性最强的物质是 (化学式);第ⅦA族中最高价氧化物对应水化物酸性最强的是
(化学式)。
(3)写出C的单质与NaOH溶液反应的离子方程式: 。
(4)写出H的单质置换出I的离子方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
科学研究发现纳米级的Cu2O可作为太阳光分解水的催化剂。
(1)火法还原CuO可制得Cu2O。已知:
lg C(s)燃烧全部生成CO时放出热量9.2kJ;
Cu2O(s)与O2(g)反应的能量变化如右图所示:
请写出用足量炭粉还原CuO(s)制备Cu2O(s)的热化学方程式 。
(2)在加热条件下用液态肼(N2H4)还原新制Cu(OH)2可制备纳米级Cu2O,同时生成N2和H2O。该反应的化学方程式为 。当生成N2 11.2 L(已换算为标准状况)时,可制备纳米级Cu2O的质量为 。
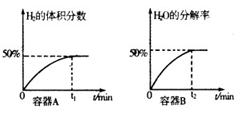
(3)某兴趣小组同学以纳米级Cu2O催化光解水蒸气并探究外界条件对化学平衡的影响。
①在体积均为lL,温度分别为T1、T2的A、B两密闭容器中都加入纳米级Cu2O并通人0.1mol水蒸气,发生反应:
 2H2O(g)
2H2O(g) 2H2(g)+O2 △H=484 kJ·mol-1
2H2(g)+O2 △H=484 kJ·mol-1
经测定A、B两容器在反应过程中发生如右图所示变化,则A、B两容器反应的温度T1 T2 (填“<”、“=”或“>”),该过程中A容器至少需要吸收能量 kJ;
②当该反应处于平衡状态时,下列既能增大反应速率,又能增大H2O(g)分解率的措施是 (填序号)。
A.向平衡混合物中充入Ar B.升高反应的温度
 C.增大反应体系的压强 D.向平衡混合物中充人O2
C.增大反应体系的压强 D.向平衡混合物中充人O2
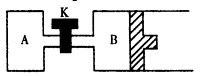
③如右图所示,当关闭K时,向容器A、B中分别充入0.2molH2O(g)向B中充入0.2mol H2O(g),起始时V(A)=V(B)=1L。在相同温度(反应过程中温度保持不变,B中活塞可以自由滑动)和催化剂存在的条件下,达到平衡时,V(B)=1.2L。请回答:
A中H2O(g)的分解率 B中H2O的分解率。(填“<”、“=”或“>”)。打开K,过一段时间重新达平衡时,B的体积为 L。(连通管中气体体积不计)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子组在指定溶液中能大量共存的是
A.中性溶液:Cu2+、Al3+、NO3-、SO42-
B.加入苯酚显紫色的溶液:K+、NH4+、Cl-、I-
C.加入Al能放出大量H2的溶液中:NH4+、Fe2+、NO3-、SO42-
D.常温下,c(H+)/c(OH一)=1×10-12的溶液:K+、AlO2-、CO32-、Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义。
(1)CO可用于炼铁,已知:Fe2O3(s) + 3C(s)=2Fe(s) + 3CO(g) ΔH 1=+489.0 kJ·mol-1,C(s) +CO2(g)=2CO(g) ΔH 2 =+172.5 kJ·mol-1
则CO还原Fe2O3(s)的热化学方程式为 ▲ 。
(2)分离高炉煤气得到的CO与空气可设计成燃料电池(以KOH溶液为电解液)。
|
 写出该电池的负极反应式: ▲ 。
写出该电池的负极反应式: ▲ 。 (3)CO2和H2充入一定体积的密闭容器中,在两种温度
下发生反应:
CO2(g) +3H2(g) CH3OH(g) +H2O(g)
CH3OH(g) +H2O(g)
|
|
(填“>”或“=”或“<”)。
②一定温度下,在容积相同且固定的两个密闭容器中,按如下方式加入反应物,一段时间后达到平衡。
| 容 器 | 甲 | 乙 |
| 反应物投入量 | 1molCO2、3molH2 | a molCO2、b molH2、 c molCH3OH(g)、c molH2O(g) |
若甲中平衡后气体的压强为开始的0.8倍,要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则c的取值范围为 ▲ 。
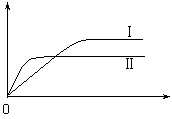
(4)利用光能和光催化剂,可将CO2和H2O(g)转化为CH4和O2。紫外光照射时,在不同催化剂(I、II、III)作用下,CH4产量随光照时间的变化见图11。在0~15小时内,CH4的平均生成速率I、II和III从大到小的顺序为 ▲ (填序号)。
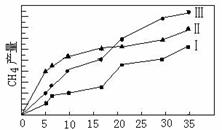
|
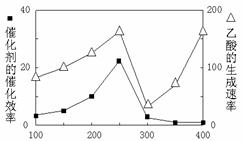
(5)以TiO2/Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。在不同温度下催化剂的催化效率与乙酸的生成速率的关系见图12。
①乙酸的生成速率主要取决于温度影响的范围是 ▲ 。
②Cu2Al2O4可溶于稀硝酸,写出有关的离子方程式: ▲ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式中,正确的是:
A.向氯化亚铁溶液中通入氯气 Fe2++Cl2 Fe3++2Cl-
B.氯气通入冷的氢氧化钠溶液中 Cl2+2OH- Cl-+ClO-+H2O
C.铝片跟氢氧化钠溶液反应: Al+2OH-=AlO2-+H2↑
D.金属铝溶于盐酸中: Al+2H +=Al3++H2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com