
取软锰矿石(主要成分为MnO2)116g 跟足量浓盐酸发生如下反应(杂质不参与反应)MnO2+4HCl(浓) 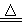 MnCl2+Cl2↑+2H2O,制得22.4L Cl2(标准状况)。下列有关说法中不正确的是
MnCl2+Cl2↑+2H2O,制得22.4L Cl2(标准状况)。下列有关说法中不正确的是
A.这种软锰矿石中MnO2的质量分数为75%
B.被氧化的HCl的物质的量为4mol
C.参加反应的HCl的质量为146g
D.被还原的MnO2的物质的量为1mol
科目:高中化学 来源:2016届重庆市高三上学期9月月考理综化学试卷(解析版) 题型:选择题
下列实验现象所对应的离子方程式不正确的是
选项 | 实 验 | 现 象 | 离子方程式 |
A |
| 在空气中放置一段时间后,溶液呈蓝色 | 4H++4I-+O2===2I2+2H2O |
B |
| 溶液由浅绿色变为红色 | 2Fe2++Cl2===2Fe3++2Cl-、 Fe3++3SCN-===Fe(SCN)3 |
C |
| 溶液由黄绿色变为无色 | Cl2+2OH-===Cl-+ClO-+H2O |
D |
| 有白色沉淀生成,溶液由红色变为无色 | Ba2++OH-+H++ |
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江苏省沭阳县高二上学期期中测试化学试卷(解析版) 题型:选择题
下列有关甲苯的实验事实中,能说明侧链对苯环性质有影响的是
A.甲苯与硝酸发生取代反应生成三硝基甲苯
B.甲苯能使热的KMnO4酸性溶液褪色
C.甲苯燃烧时产生带浓烈黑烟的火焰
D.1 mol甲苯最多能与3 mol氢气发生加成反应
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江苏省沭阳县高二上学期期中测试化学试卷(解析版) 题型:选择题
下列有关化学用语表示正确的是
A.乙烷的结构式:C2H6
B.3—甲基—1—丁烯的结构简式:(CH3)2CHCH=CH2
C.乙炔的电子式:
D.乙醇分子的比例模型: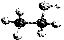
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江苏省沭阳县高一上学期期中测试化学试卷(解析版) 题型:选择题
我国古代就有湿法炼铜的记载“曾青得铁则化为铜”,相关反应的化学方程式为:Fe+CuSO4=Cu+FeSO4。下列有关该反应的说法中正确的是
A.Fe被氧化 B.CuSO4是还原剂
C.Fe是氧化剂 D.CuSO4发生氧化反应
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江苏省沭阳县高一上学期期中测试化学试卷(解析版) 题型:选择题
下列气体有颜色且具有刺激性气味的是
A.O2 B.Cl2 C.NH3 D.N2
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江苏省高二上学期期中测试化学试卷(解析版) 题型:填空题
工业制硫酸生产流程如下图:

催化室的反应为:2SO2+O2 2SO3 △H<0
2SO3 △H<0
(1)在沸腾炉中,需要将黄铁矿粉碎的目的是 。
(2)在催化反应室,下列措施中有利于提高SO2平衡转化率的有 。(填写编号)
a.减少压强 b.升高温度 c.不断补充空气 d.及时分离出SO3
(3)在450℃、常压和钒催化条件下,在容积为VL的恒容容器中加入2n molSO2和n molO2
判断反应达到平衡状态的标志是 。(填写编号)
a.SO2和SO3浓度相等 b.SO2百分含量保持不变
c.容器中气体的压强不变 d.SO3的生成速率与SO2的消耗速率相等
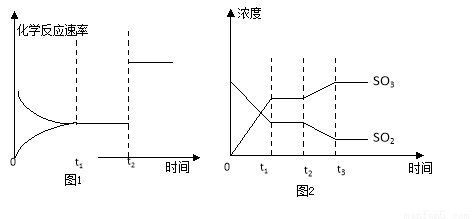
(4)图1、2表示该SO2和O2的反应在时刻t1达到平衡、在时刻t2因改变某个条件而发生变化的情况:
① 图1中时刻t2发生改变的条件是 。
② 图2中时刻t2发生改变的条件是 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省高二上学期期中测试化学试卷(解析版) 题型:填空题
甲醇的研究成为当代社会的热点.
Ⅰ.甲醇燃料电池(DNFC)被认为是21世纪电动汽车最佳候选动力源.
(1)101kP 时,1mol CH3OH完全燃烧生成稳定的氧化物放出热量726.51kJ/mol,则甲醇燃烧的热化学方程式为__________.
(2)甲醇质子交换膜燃料电池中将甲醇蒸汽转化为氢气的两种反应原理是:
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g)△H1=+49.0kJ•mol﹣1
②CH3OH(g)+ O2(g)=CO2(g)+2H2(g)△H2
O2(g)=CO2(g)+2H2(g)△H2
已知H2(g)+ O2(g)=H2O(g)△H=﹣241.8kJ•mol﹣1
O2(g)=H2O(g)△H=﹣241.8kJ•mol﹣1
则反应②的△H2=__________.
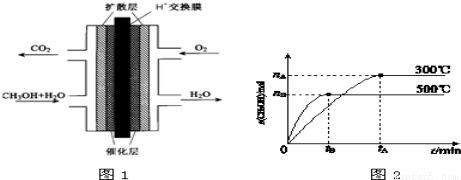
(3)甲醇燃料电池的结构示意图如图1.负极发生的电极反应为____________________.
Ⅱ.一定条件下,在体积为3L的密闭容器中反应CO(g)+2H2(g)?CH3OH(g)达到化学平衡状态.
(1)根据图2,纵坐标为CH3OH的物质的量,升高温度,K值将__________(填“增大”、“减小”或“不变”).
(2)500℃时,从反应开始到达到化学平衡,以H2的浓度变化表示的化学反应速率是__________(用nB、tB表示).
(3)判断该可逆反应达到化学平衡状态的标志是__________(填字母).
a.CO、H2、CH3OH的浓度均不再变化
b.混合气体的密度不再改变
c.混合气体的平均相对分子质量不再改变
d.v生成(CH3OH)=v消耗(CO)
e.混合气中n(CO):n(H2):n(CH3OH)=1:2:1
(4)300℃时,将容器的容积压缩到原来的 ,在其他条件不变的情况下,对平衡体系产生的影响是__________(填字母).
,在其他条件不变的情况下,对平衡体系产生的影响是__________(填字母).
a.c(H2)减少 b.正反应速率加快,逆反应速率减慢
c.CH3OH 的物质的量增加 d.重新平衡时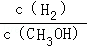 减小.
减小.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com