


科目:高中化学 来源: 题型:

| A、a是锌,b是铜,c是稀硫酸溶液 |
| B、a是铁,b是银,c是硝酸银溶液 |
| C、a是银,b是铁,c是硝酸银溶液 |
| D、a是碳,b是铁,c是氯化铜溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na+ Ca2+ OH- CO32- |
| B、Al3+ H+ Cl- SO42- |
| C、Fe2+ H+ NO3- SO42- |
| D、Na+ H+ SO32- ClO- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 阳离子 | H+、Na+、A13+、Ag+、Ba2+ |
| 阴离子 | OH-、C1-、CO32-、NO3-、SO42- |

| 浓硝酸 |
| 一定量NaOH |
| D的溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 2010年上海世博会的三大主题是“低碳、和谐、可持续发展”,意在倡导人们合理、科学地利用能源,提高能源的利用率.由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了全社会的普遍关注.
2010年上海世博会的三大主题是“低碳、和谐、可持续发展”,意在倡导人们合理、科学地利用能源,提高能源的利用率.由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了全社会的普遍关注.查看答案和解析>>
科目:高中化学 来源: 题型:
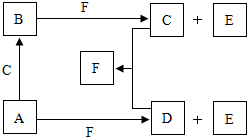
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com