
(15分)(化学与技术)某硫酸厂以含有SO2的尾气、氨气等为原料,合成有重要应用价值的硫化钙、硫酸钾、亚硫酸铵等物质。合成路线如下:
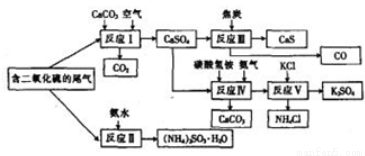
(1)写出反应Ⅲ的化学方程式: 。
(2)下列有关说法正确的是 (填字母)
A.反应Ⅰ中需鼓入足量空气,以保证二氧化硫充分氧化生成硫酸钙
B.反应Ⅱ和反应Ⅲ的基本反应类型相同
C.反应Ⅳ需控制在60---70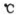 ,目的之一是减少碳酸氢铵的分解
,目的之一是减少碳酸氢铵的分解
D.反应Ⅴ中的副产物氯化铵可用作氮肥
(3)(NH4)2SO3可用于电厂等烟道气中脱氮,将氮氧化物转化为氮气,同时生成一种氮肥,形成共生系统。写出二氧化氮与亚硫酸铵反应的化学方程式: 。
(4)很多硫酸厂为回收利用SO2,直接用氨水吸收法处理尾气。
① 用15.0 mL 2.0 mol/L氨水吸收标准状况下448 mL SO2,吸收液中的溶质为
。
② 某同学用酸性KMnO4溶液滴定上述吸收液,当达到滴定终点时,消耗KMnO4溶液25.00 mL,则酸性KMnO4,溶液中c(KMnO4) = 。
(5)氨气用途广泛,可以直接用于燃料电池,下图是用氨水作原料的燃料电池的工作原理。

氨气燃料电池的电解质溶液最好选择 (填“酸性”、“碱性”或“中性”)溶液,氨气燃料电池的反应是氨气与氧气生成一种常见的无毒气体和水,该电池总反应的化学方程式是 ,负极的电极反应式是
。
(1)CaSO4+4C CaS+4CO↑;
CaS+4CO↑;
(2)ACD;
(3)4(NH4)2SO3+2NO2=4(NH4)2SO4+N2;
(4)①(NH4)2SO3,(NH4)HSO3;
②0.32mol/L
(5)碱性;4NH3+3O2=2N2+6H2O;2 NH3-6e-+6OH-=N2+6 H2O.
【解析】
试题分析:(1)由流程图可知反应III是硫酸钙与焦炭在高温条件下反应生成CaS和CO,化学方程式为CaSO4+4C CaS+4CO↑;
CaS+4CO↑;
(2)A、反应I中鼓入足量的空气目的就是使二氧化硫充分被氧化为硫酸钙,正确;B、反应II是二氧化硫与氨水的化合反应,而反应III不属于基本反应类型,二者的基本反应类型不同,错误;C、反应Ⅳ需控制在60~70℃,防止碳酸氢铵在温度过高时分解得不到需要的目标产物,正确;D、反应V的产物之一是氯化铵,含有N元素,可用作氮肥,正确,答案选ACD;
(3)二氧化氮与亚硫酸铵反应,二氧化氮具有强氧化性能氧化亚硫酸铵反应,生成硫酸铵,本身被还原为氮气,由原子守恒可知化学方程式为4(NH4)2SO3+2NO2=4(NH4)2SO4+N2;
(4)①标准状况下448 mL SO2的物质的量是0.02mol,氨气的物质的量是0.015L×2.0mol/L=0.03mol,二氧化硫与氨气的物质的量之比1/2<2/3<1,所以吸收液中的溶质既有(NH4)2SO3,也有(NH4)HSO3;
②用KMnO4溶液去滴定吸收液,实质是高锰酸钾与二氧化硫反应,根据得失电子守恒,0.02mol二氧化硫失去电子的物质的量是0.02mol×2=0.04mol,高锰酸钾中Mn元素化合价降低为+2价,则0.025L×5×c=0.04,所以高锰酸钾的浓度c=0.32mol/L;
(5)氨气燃料电池中的电解质溶液最好选择碱性溶液,因为该反应的实质是氨气与氧气反应,所以尽量减少氨气在溶液中的溶解度,氨气溶于水显碱性,所以氨气在碱性溶液中的溶解度最小,所以选择碱性溶液;氨气与氧气生成一种常见的无毒气体和水,则无毒气体是氮气,所以总反应的方程式为4NH3+3O2=2N2+6H2O,负极发生氧化反应,从总反应方程式中可看出,N元素的化合价升高,所以氨气发生氧化反应,结合电解质溶液,则负极的反应式为2 NH3-6e-+6OH-=N2+6 H2O.
考点:考查对反应流程的分析,二氧化硫的化学性质,氧化还原反应的计算,原电池反应原理的应用


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2015届北京市高三上学期第一次质量检测化学试卷(解析版) 题型:选择题
下列相关反应的离子方程式书写正确的是
A.氢氧化铁溶于氢碘酸:Fe(OH)3+3H+ = Fe3++3H2O
B.硫酸铜溶液显酸性:Cu2+ + 2H2O == Cu(OH)2↓+ 2H+
C.向碳酸氢铵溶液中加过量石灰水并加热:NH4++OH-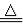 NH3↑+H2O
NH3↑+H2O
D.用酸化的高锰酸钾溶液氧化双氧水:2MnO4-+6H++5H2O2 = 2Mn2++5O2↑+8H2O
查看答案和解析>>
科目:高中化学 来源:2015届北京市朝阳区高三年级第一学期期中统一考试化学试卷(解析版) 题型:选择题
下列常见物质的分类不正确的是
A.CO2是酸性氧化物 B.氨水是混合物
C.冰醋酸是电解质 D.纯碱是碱
查看答案和解析>>
科目:高中化学 来源:2015届北京十中高三第一学期期中化学试卷(解析版) 题型:选择题
下列解释事实或实验现象的化学用语正确的是
A.向沸水中滴加饱和FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2O 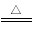 Fe(OH)3↓+ 3H+
Fe(OH)3↓+ 3H+
B.酸性KI淀粉溶液久置后变蓝4I-+O2+2H2O=2I2+4OH-
C.实验室盛装NaOH溶液的试剂瓶不能用玻璃塞 SiO2 +2OH- = SiO32-+H2O
D.钢铁表面的水膜酸性较强时,水膜中的H+会被还原O2+4H++4e- = 2H2O
查看答案和解析>>
科目:高中化学 来源:2015届北京十中高三第一学期期中化学试卷(解析版) 题型:选择题
下列化学用语正确的是
A.硫的原子结构示意图:
B.NH4Br的电子式: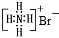
C.Be2+离子中的质子数和电子数之比为2:1
D.中子数为146、原子序数为92的铀(U)原子: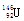
查看答案和解析>>
科目:高中化学 来源:2015届内蒙古赤峰市高三上学期9月质量检测化学试卷(解析版) 题型:填空题
(8分)硫、氯及其化合物有广泛的用途。
(1)“氯氧化法”是指在碱性条件下用Cl2将废水中的CN-氧化成无毒的物质。CN-被氧化后的产物为 (填化学式)。
(2)“氯胺(NH2Cl)消毒法“是在用液氯处理自来水的同时通入少量的氨气,发生反应:
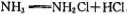 ,生成 的NH2Cl能部分水解生成强氧化性的物质,起消毒杀菌的作用。氨氯能用于消毒杀菌的原因是 (用化学方程式表示)。
,生成 的NH2Cl能部分水解生成强氧化性的物质,起消毒杀菌的作用。氨氯能用于消毒杀菌的原因是 (用化学方程式表示)。
(3)如图所示装置和药品可用来制备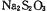 。
。

①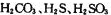 三种酸的酸性由强到弱的顺序位 。
三种酸的酸性由强到弱的顺序位 。
②配平广口瓶中生成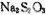 反应的化学方程式:
反应的化学方程式:
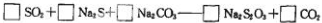
查看答案和解析>>
科目:高中化学 来源:2015届内蒙古赤峰市高三上学期9月质量检测化学试卷(解析版) 题型:选择题
在酸性介质中,向MnSO4溶液中滴加(NH4)2S2O8(过二硫酸铵)溶液会发生如下离子反应: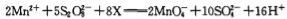 ,下列说法正确的是:
,下列说法正确的是:
A.X是 H2O
B.还原性:SO42->Mn2+
C.该反应中酸性介质可以为盐酸
D.每生成0.1 molSO42-转移电子0.05 mol
查看答案和解析>>
科目:高中化学 来源:2015届内蒙古赤峰市宁城县高三上学期摸底统一考试化学试卷(解析版) 题型:选择题
利用下图所示装置,当X、Y选用不同材料时,可将电解原理广泛应用于工业生产。下列说法中正确的是( )
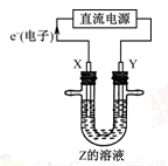
A.氯碱工业中,若X、Y均为石墨,Y附近能得到氯气
B.铜的精炼中,X是纯铜,Y是粗铜,Z是CuSO4
C.外加电流的阴极保护法中,Y是待保护金属
D.电镀工业中,X是待镀金属,Y是镀层金属
查看答案和解析>>
科目:高中化学 来源:2015届内蒙古高二下学期期末考试化学试卷(解析版) 题型:填空题
(普通班)(15分)已知常温下,AgBr的Ksp=4.9×10-13,AgI的Ksp=8.3×10-17.
(1)AgBr固体在水中达到溶解平衡,写出其表达式 ;此时溶液中c(Ag+)= mol/L;
(2)现向AgBr的悬浊液中:①加入AgNO3固体,则c(Br -) (填“变大”、“变小”或“不变”,下同);②若改加更多的AgBr固体,则c(Ag+) ;
③若改加更多的KI固体,则c(Ag+) ,c(Br -) 。
(3)有关难溶盐的溶度积及溶解度有以下叙述,其中正确的是( )
A.将难溶电解质放入纯水中,溶解达到平衡时,电解质离子的浓度的乘积就是该物质的溶度积
B.两种难溶盐电解质,其中Ksp小的溶解度也一定小
C.难溶盐电解质的Ksp与温度有关
D.向AgCl的悬浊液中加入适量的水,使AgCl再次达到溶解平衡,AgCl的Ksp不变,其溶解度也不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com