
(1)FeI2溶液中通入少量Cl2及过量Cl2时反应的离子方程式。
少量Cl2:____________________________________________。
过量Cl2:____________________________________________。
(2)已知Ca3(PO4)2、CaHPO4均不溶于水,且Ca3(PO4)2的溶解度比CaHPO4的溶解度小。将0.05 mol·L-1 Ca(H2PO4)2溶液与0.15 mol·L-1 NaOH溶液等体积混合,搅拌后静置,充分反应。请写出反应的离子方程式:_______________________________________________。
(1)2I-+Cl2====I2+2Cl-
2Fe2++4I-+3Cl2====2Fe3++2I2+6Cl-
(2)3Ca2++6![]() +9OH-====9H2O+Ca3(PO4)2↓+
+9OH-====9H2O+Ca3(PO4)2↓+![]() +3
+3![]()
解析:(1)由于氧化性Cl2>Br2>Fe3+>I2,
还原性I->Fe2+>Br->Cl-,
所以FeI2溶液中通入少量Cl2时,应先氧化I-;这不同于FeBr2溶液中通入少量Cl2时,先氧化Fe2+。据此可知:
少量Cl2时:2I-+Cl2====I2+2Cl-
过量Cl2时:2Fe2++4I-+3Cl2====2Fe3++2I2+6Cl-
(2)这是一道定量反应离子方程式的书写问题,所以需要算清反应物的物质的量之比,然后才能写出离子方程式。
![]()
1 mol Ca(H2PO4)2与3 mol NaOH反应的离子方程式为:
![]()
〔Ca3(PO4)2较CaHPO4难溶于水,![]() 有剩余,不会生成CaHPO4沉淀〕
有剩余,不会生成CaHPO4沉淀〕
方程两边都乘以3得:
3Ca2++6![]() +9OH-====Ca2(PO4)2↓+
+9OH-====Ca2(PO4)2↓+![]() +3
+3![]() +9H2O
+9H2O


科目:高中化学 来源: 题型:
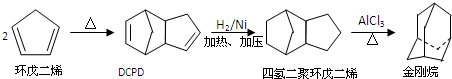
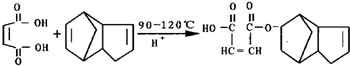
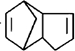

| H+ |
| △ |
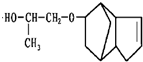
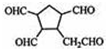
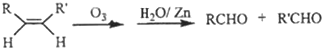 ,请写出下列反应产物的结构简式:
,请写出下列反应产物的结构简式:
| O3 |
| H2O/Zn |

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 方程式 | 反应类型 |
| (1)实验室制备乙酸乙酯 | |
| (2)乙酸乙酯和氢氧化钠溶液共热 | |
| (3)2-丙醇的催化氧化 | |
| (4)将金属钠投入乙醇 | |
| (5)乙醛与新制氢氧化铜悬浊液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)FeI2溶液中通入少量Cl2及过量Cl2时反应的离子方程式。
少量Cl2:______________________________________________________。
过量Cl2:______________________________________________________。
(2)已知Ca3(PO4)2、CaHPO4均不溶于水,且Ca3(PO4)2的溶解度比CaHPO4的溶解度小。将0.05 mol·L-1 Ca(H2PO4)2溶液与0.15 mol·L-1 NaOH溶液等体积混合,搅拌后静置,充分进行反应。请写出反应的离子方程式:__________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com