
【题目】右图是一个一次性加热杯的示意图.当水袋破裂时,水与固体碎块混和,杯内食物温度逐渐上升.制造此加热杯可选用的固体碎块是( ) 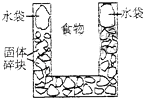
A.硝酸铵
B.生石灰
C.氯化镁
D.食盐
 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源: 题型:
【题目】LiAlH4( )、LiH既是金属储氢材料又是有机合成中的常用试剂,遇水均能剧烈分解释放出H2,LiAlH4在125℃分解为LiH、H2和Al。下列说法不正确的是( )
)、LiH既是金属储氢材料又是有机合成中的常用试剂,遇水均能剧烈分解释放出H2,LiAlH4在125℃分解为LiH、H2和Al。下列说法不正确的是( )
A. 1 mol LiAlH4在125℃完全分解,转移3 mol电子
B. LiH与D2O反应,所得氢气的摩尔质量为4 g/mol
C. LiAlH4溶于水得到无色溶液,化学方程式可表示为:LiAlH4 + 2H2O![]() LiAlO2 + 4H2↑
LiAlO2 + 4H2↑
D. LiAlH4与乙醛作用生成乙醇,LiAlH4作还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机化合物的说法正确的是( )
A. 乙烯和聚乙烯都能使溴的四氯化碳溶液褪色
B. 乙烷和乙烯都能使酸性KMnO4溶液褪色
C. 植物油和动物脂肪都不能使溴水褪色
D. 乙醇和乙酸都能与金属钠反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属及其化合物在生产中用途广泛。
I.利用生产硼砂的废渣一硼镁泥(主要成分为MgCO3、SiO2,还含有少量Fe2O3、MnO2、CaO等)为主要原料制取轻质碳酸镁[MgCO3·Mg(OH)2·2H2O]的工业流程如下:
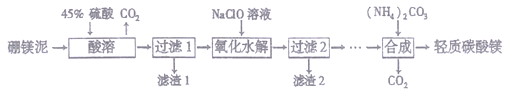
(1)写出“酸溶”一步中,MgCO3和硫酸反应的离子方程式________________________。
(2)滤渣2的主要成分有MnO2和________,写出生成MnO2的离子方程式_____________。
(3)“合成”时需通蒸汽至80℃,边加热边搅拌,温度不能超80℃的原因是______________。
II.从含铜丰富的自然资源黄铜矿(CuFeS2)冶炼铜的工艺流程如下:
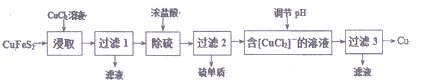
已知:①CuFeS2+3CuCl2=4CuCl↓+FeCl2+2S↓ ②+1价的Cu在酸性条件下易歧化
(4)浸取时,若改用FeCl3溶液,也能生成CuCl和S,该反应化学方程式为_________________。
(5)若过滤1所得滤液中只含FeCl2,则将其在空气中加热蒸干、灼烧后,所得固体的化学式为____________________。
(6)过滤3所得滤液中的CuCl2可循环使用,为保持流程持续循环,每生成1molCu,理论上需补充CuCl2的物质的量为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)化学反应中的能量变化,是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同所致。下图为N2(g)和O2(g)生成NO(g)过程中的能量变化:

N2(g)和O2(g)生成NO(g)过程中的能量变化
①人们通常把拆开1mol某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,则N≡N的键能为________kJ/mol。
②由上图写出N2(g)和O2(g)生成NO(g)的热化学方程式:___________________________
(2)①已知:C(石墨,s)+O2(g)===CO2(g) ΔH1=-393.5kJ/mol
2H2(g)+O2(g)===2H2O(l) ΔH2=-571.6kJ/mol
2C2H2(g)+5O2(g)===4CO2(g)+2H2O(l) ΔH3=-2599.2kJ/mol,
则由C(石墨,s)和H2(g)反应生成1mol C2H2(g)时ΔH=________kJ/mol。
②火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当把0.4mol液态肼和0.8mol H2O2混合反应,生成氮气和水蒸气,放出256.7kJ的热量(相当于25℃、101 kPa下测得的热量)。反应的热化学方程式为__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响。在常温下按照如下方案完成实验。
实验编号 | 反应物 | 催化剂 |
① | 10 mL 2% H2O2溶液 | 无 |
② | 10 mL 5% H2O2溶液 | 无 |
③ | 10 mL 5% H2O2溶液 | 1 mL 0.1 mol·L-1 FeCl3溶液 |
④ | 10 mL 5% H2O2溶液+少量HCl溶液 | 1 mL 0.1 mol·L-1 FeCl3溶液 |
⑤ | 10 mL 5% H2O2溶液+少量NaOH溶液 | 1 mL 0.1 mol·L-1 FeCl3溶液 |
(1)催化剂能加快化学反应速率的原因是_________________________________________。
(2)H2O2分解的化学方程式为________________________。
(3)实验①和②的目的是_______________________________________________________。
实验时由于没有观察到明显现象而无法得出结论。资料显示,通常条件下H2O2稳定,不易分解。为了达到实验目的,你对原实验方案的改进是______________________________。
(4)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如下图:
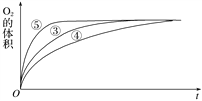
分析上图能够得出的实验结论是_______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】体积相同的甲、乙两容器,一个充满 CO,另一个充满 C2H4 的混合气体。同温同压下,两容器内气体一定具有相同的
A. 原子总数 B. 分子总数
C. 电子总数 D. 质子总数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应aA(g)+bB(g)cC(g)+dD(g),取a mol A和b mol B置于V L的容器中,1min后,测得容器内A的浓度为x molL﹣1 , 这时B的浓度为 molL﹣1 , C的浓度为 molL﹣1 . 这段时间内反应的平均速率若以物质A的浓度变化来表示,应为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com