(2010?龙岩模拟)鸡蛋壳中含有大量钙、少量镁和钾等元素.实验室可用图示流程测定鸡蛋壳中钙、镁元素含量.依据的反应可以表示为:Ca
2++Y
2-=CaY、Mg
2++Y
2-=MgY.回答下列问题.
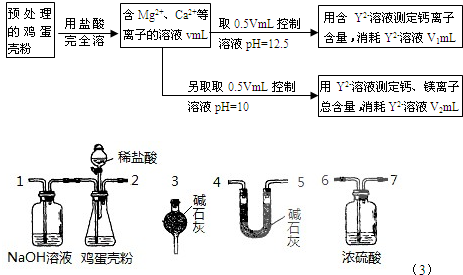
(1)测定Ca
2+、Mg
2+总含量时,控制溶液pH=10.若pH过大,测定结果将
偏小
偏小
(填“偏大”、“偏小”或“无影响”);
(2)测定Ca
2+含量的关键是控制溶液的pH,使溶液中Mg
2+形成沉淀,若要使溶液中c(Mg
2+)不大于1.2×10
-7mol/L,则溶液pH应不小于
12
12
(已知:ksp[Mg(OH)
2]=1.2×10
-11,上述实验均在室温下进行).
(3)如果鸡蛋壳粉质量为mg,溶液中Y
2+浓度为c mol/L,则鸡蛋壳样品中镁元素质量分数是
.
(4)有同学提出可采用如右装置、通过测定鸡蛋壳与盐酸反应产生的二氧化碳的量就能测定鸡蛋壳中的钙的总含量.
①采用该方法进行实验,各装置从左到右的连接顺序依次1-2-
6-7-4-5-3或6-7-5-4-3
6-7-4-5-3或6-7-5-4-3
(填各装置对应接口的数字序号).
②若排除实验仪器和操作的影响因素,此实验方法测得的结果是否准确?
答:
不一定准确
不一定准确
(填“准确”、“不准确”或“无法判断”).原因是
如果蛋壳中钙元素全部以碳酸钙形式存在,且不再含有能与盐酸反应产生酸性气体的其他物质,则测定结果准确;否则不准确
如果蛋壳中钙元素全部以碳酸钙形式存在,且不再含有能与盐酸反应产生酸性气体的其他物质,则测定结果准确;否则不准确
.




 名校课堂系列答案
名校课堂系列答案 (2010?龙岩模拟)X、Y、Z、Q为短周期非金属元素,R是长周期元素.X原子的电子占据2个电子层且原子中成对电子数是未成对电子数的2倍;Y的基态原子有7种不同运动状态的电子;Z元素在地壳中含量最多;Q是电负性最大的元素;R+离子只有三个电子层且完全充满电子.
(2010?龙岩模拟)X、Y、Z、Q为短周期非金属元素,R是长周期元素.X原子的电子占据2个电子层且原子中成对电子数是未成对电子数的2倍;Y的基态原子有7种不同运动状态的电子;Z元素在地壳中含量最多;Q是电负性最大的元素;R+离子只有三个电子层且完全充满电子.

 A.该晶体属于分子晶体
A.该晶体属于分子晶体





