
| A. | 该温度下此反应的平衡常数K=400 | |
| B. | 其他条件不变,再充入0.3mol SO2和0.2mol O2平衡时,SO2的体积分数增大 | |
| C. | 平衡时,SO2的转化率为95% | |
| D. | 前2min SO2的平均反应速率0.02mol/(L•s) |
分析 依据化学平衡三段式列式计算,设二氧化硫转化物质的量为x,则
2SO2+O2 =2SO3
起始量(mol) 0.3 0.2 0
变化量(mol) x 0.5x x
平衡量(mol)0.3-x 0.2-0.5x x
气体物质的量之比和气体压强之比,以此解答该题.
解答 解:在500℃时,把0.3mol SO2和0.2mol O2充入一个体积为10L并盛有V2O5(催化剂)的真空密闭容器中,保持温度不变,经2min后,容器内的压强不再变化,此时容器内压强减小20%,设二氧化硫转化物质的量为x,则
2SO2+O2 =2SO3
起始量(mol) 0.3 0.2 0
变化量(mol) x 0.5x x
平衡量(mol)0.3-x 0.2-0.5x x
容器内的压强不再变化,此时容器内压强减小20%,即气体物质的量减少20%,得到(0.3+0.2)×(1-20%)=0.3-x+0.2-0.5x+x,
x=0.20mol,
A.该温度下此反应的平衡常数K=$\frac{(\frac{0.2mol}{10L})^{2}}{(\frac{0.1mol}{10L})^{2}(\frac{0.1mol}{10L})}$=400,故A正确;
B.其他条件不变,再充入0.3mol SO2和0.2mol O2平衡时,相当于在原来基础上增大压强,平衡正向移动,则SO2的体积分数减小,故B错误;
C.平衡时,SO2的转化率为$\frac{0.2mol}{0.3mol}×100%$=66.7%,故C错误;
D.前2min SO2的平均反应速率为$\frac{\frac{0.2mol}{10L}}{2min}$=0.01mol/(L•s),故D错误.
故选A.
点评 本题考查了化学平衡常数、化学反应速率的计算及化学平衡的影响因素等知识,题目难度中等,试题涉及的知识面广,应加强平时知识的积累,试题有利于培养学生灵活应用所学知识的能力.


科目:高中化学 来源: 题型:选择题
| A. | 126C和146C是2种核素,他们互称同位素 | |
| B. | 近期化学研究者开发出被称为第五形态的固体碳,这种新的碳结构称作“纳米泡沫”,它外形类似海绵,比重极小,并具有磁性.纳米泡沫碳与C60互称同素异形体 | |
| C. |  与 与 互为同分异构体 互为同分异构体 | |
| D. | 硝基苯可看成是由  和-NO2两种基团组成 和-NO2两种基团组成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
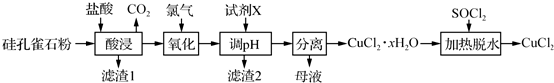
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题


查看答案和解析>>
科目:高中化学 来源: 题型:实验题
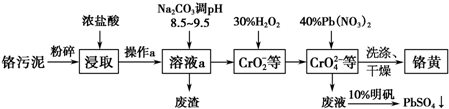
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 苯乙酸铜是合成优良催化剂、传感材料--纳米氧化铜的重要前驱体之一.下面是它的一种实验室合成路线:
苯乙酸铜是合成优良催化剂、传感材料--纳米氧化铜的重要前驱体之一.下面是它的一种实验室合成路线: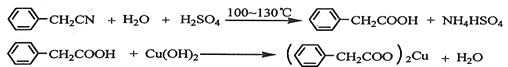
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ①④⑤ | C. | ②③④ | D. | ②④⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com