
【题目】由下列实验事实得出的结论正确的是( )
A. 由SiO2不能与水反应生成H2SiO3,可知SiO2不是H2SiO3的酸酐
B. 由SiO2+2C![]() Si+2CO↑,可知碳的非金属性大于硅
Si+2CO↑,可知碳的非金属性大于硅
C. CO2通入Na2SiO3溶液产生白色沉淀,可知酸性H2CO3>H2SiO3
D. SiO2可与NaOH溶液反应,也可与氢氟酸反应,可知SiO2为两性氧化物
【答案】C
【解析】试题分析:A.二氧化硅难溶于水,硅酸分解生成二氧化硅,酸酐是酸对应氧化物中元素化合价和酸化合价相同;
B.该反应中C的还原性大于Si的还原性,无法比较C、Si的非金属性;
C.碳酸酸性大于硅酸,可以强酸制备弱酸;
D.两性氧化物是指和酸碱反应生成盐和水的氧化物,二氧化硅和氢氟酸反应是特殊性,不能和其他酸发生反应.
解:A.二氧化硅难溶于水,酸酐是酸对应氧化物中元素化合价和酸化合价相同,硅酸分解生成二氧化硅,二氧化硅是硅酸的酸酐,故A错误;
B.该反应中C的还原性大于Si的还原性,无法比较C、Si的非金属性,非金属性应根据氢化物稳定性、最高价含氧酸的酸性、单质氧化性等比较,故B错误;
C.碳酸酸性大于硅酸,可以强酸制备弱酸,CO2通入Na2SiO3溶液产生白色沉淀,可知酸性H2CO3>H2SiO3,故C正确;
D.两性氧化物是指和酸碱反应生成盐和水的氧化物,二氧化硅和氢氟酸反应是特殊性,不能和其他酸发生反应,二氧化硅和碱溶液反应生成盐和水是酸性氧化物,故D错误;
故选C.


 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案科目:高中化学 来源: 题型:
【题目】由CH3CH2CH2Br制备CH3CH(OH)CH2OH,依次发生的反应类型和反应条件都正确的是
选项 | 反应类型 | 反应条件 |
A | 加成、取代、消去 | KOH醇溶液/加热、KOH水溶液/加热、常温 |
B | 消去、加成、取代 | NaOH醇溶液/加热、常温、KOH水溶液/加热 |
C | 氧化、取代、消去 | 加热、KOH醇溶液/加热、KOH水溶液/加热 |
D | 消去、加成、水解 | NaOH水溶液/加热、常温、NaOH醇溶液/加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水淡化是指除去海水中的盐分以获得淡水的工艺过程,其方法较多,如反渗透法、电渗析法、离子交换法等,下列方法中也是用来进行海水淡化的是( )
A.过滤法
B.萃取法
C.分液法
D.蒸馏法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,一定浓度的某溶液,由水电离的出的c(OH-)=1×10-4 mol/L,则该溶液中的溶质可能是
A.H2SO4 B.NaOH C.KHSO4 D.CH3COONa
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学 — 有机化学基础】3-对甲苯丙烯酸甲酯(E)是一种用于合成抗血栓药的中间体,其合成路线如下:
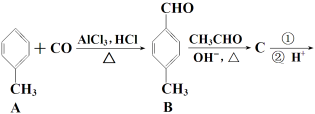
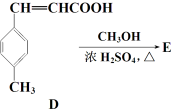
已知:HCHO+CH3CHO![]() CH2===CHCHO+H2O
CH2===CHCHO+H2O
(1) A的核磁共振氢谱图显示峰的面积比为_________;A→B新生成的官能团名称为 。
(2) B的同系物G(C9H10O)的同分异构体有多种,其中满足下列条件的同分异构体数目有 种(不考虑立体异构)① 遇FeCl3溶液呈紫色;②苯环上有两个取代基。
(3) C的结构简式为___________;D→E的反应类型为___________。
(4) 过程①选用的试剂可选用下列中的___________。
a.溴水 b. 银氨溶液 c.酸性KMnO4溶液 d.新制Cu(OH)2悬浊液
(5) ![]() 是E的一种同分异构体,该物质与足量NaOH溶液共热的化学方程式为__________________________。
是E的一种同分异构体,该物质与足量NaOH溶液共热的化学方程式为__________________________。
(6) E在一定条件下可以合成高聚物F,F的结构简式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】完全沉淀等物质的量浓度的NaCl、MgCl2、A1C13溶液中的Cl-,消耗等物质的量浓度的AgNO3溶液的体积比为3: 2: 1,则上述溶液的体积比为
A.1: 1: 1 B.3: 2: 1 C.9: 3: 1 D.6: 3: 2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请回答氯碱工业的如下问题:
(1)氯气、烧碱是电解食盐水时按照固定的比率k(质量比)生成的产品。理论上k=__________
(2)原料粗盐中常含有泥沙和Ca2+、Mg2+、Fe3+、SO42-等杂质,必须精制后才能供电解使用。精制时,粗盐溶于水过滤后,还要加入的试剂分别为①Na2CO3、②盐酸 ③BaCl2,
这三种试剂添加的合理顺序是______________(填序号)
(3)氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节能30%以上。在这种工艺设计中,相关物料的传输与转化关系如下图所示,其中的电极未标出,所用的离子膜都只允许阳离子通过。
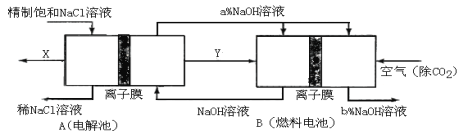
①图中X、Y分别是_____________、_____________(填化学式),分析比较图示中氢氧化钠质量分数a%与b%的大小 。
②分别写出燃料电池B中正极、负极上发生的电极反应: 、 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学—物质结构与性质】如右图是元素周期表的一部分。已知R的核电荷数小于36,气态氢化物沸点:MHn>YHn。
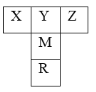
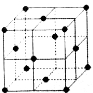
(1)表中五种元素第一电离能最大的是 (填元素符号),Y的最简单氢化物分子的空间构型为 ,基态R原子中有 个未成对电子。
(2)Y的最高价氧化物熔点比M的最高价氧化物熔点低,原因是 ,YZ-中σ键与π键的个数比为 。
(3)YO32-中Y原子的杂化方式是 ,写出一种与YO32-互为等电子体的粒子 (用化学符号表示)。
(4)Z的一种常见氢化物能与硫酸铜反应生成配合物。请用结构简式表示该配合物中的阳离子: 。
(5)如图为某金属单质的面心立方晶胞结构示意图,该晶体中配位数是 ;测得此晶体的密度为2.7g.cm-3,晶胞的边长为0.405nm,则此金属原子的相对原子质量为 (结果保留整数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(12分)图表法是常用的科学研究方法,下表列出了同周期的四种短周期元素的部分性质(“电负性”即元素对应原子吸引电子能力的标度):
元素编号 | A | B | C | D | E |
电负性 | 3.0 | 2.5 | X[ | 1.5 | 0.9 |
原子半径(单位nm) | 0.099 | 0.102 | 0.110 | 0.143 | 0.186 |
主要化合价 | -1,+7 | -2,+6 | -3,+5 | +3 | +1 |
请回答下列问题:
(1)写出E元素的离子结构示意图 ;
(2)X的值应为 (填字母);
A.3.6 B.3.1 C.2.1 D.1.4
(3)分析表中数据,简述同周期元素(除惰性气体)电负性大小与原子半径的关系 ;
(4)A、B、C三种元素形成的氢化物中,其稳定性由强到弱的顺序是: (用化学式表示)
(5)A、D最高价氧化物对应水化物相互反应的化学方程式:
(6)D、E最高价氧化物对应水化物相互反应的离子方程式:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com