
��1����֪���淴Ӧ��M(g)��N(g)![]() P(g)��Q(g) ��H��0��
P(g)��Q(g) ��H��0��
��Ҫ����Q��Ũ�ȣ��������������������¿��Բ�ȡ�Ĵ�ʩΪ ������ţ���
A������һ����M B�����ͷ�Ӧ�¶� C�����߷�Ӧ�¶�
D����С������� E��������� F�������һ����P
��2����˹�����������Ϳ�ѧ�о����к���Ҫ�����塣��Щ��Ӧ�ķ�Ӧ����Ȼ��ֱ�Ӳ�ã�����ͨ����ӵķ����ⶨ���ָ�������3���Ȼ�ѧ��Ӧ����ʽ��
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ��H����24.8 kJ��mol��1
3Fe2O3(s)+ CO(g)==2Fe3O4(s)+ CO2(g) ��H����47.2 kJ��mol��1
Fe3O4(s)+CO(g)==3FeO(s)+CO2(g) ��H����640.5 kJ��mol��1
д��CO���廹ԭFeO����õ�Fe �����CO2������Ȼ�ѧ��Ӧ����ʽ��
_________________ ��
��3�������Ϊ1 L���ܱ������У�����1 mol CO2��3 mol H2��һ�������·�����Ӧ�� CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ��H=��49.0 kJ/mol�� ��
CH3OH(g)+H2O(g) ��H=��49.0 kJ/mol�� ��
��CO2��CH3OH(g)��Ũ����ʱ��仯����ͼ��ʾ��
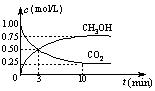
�ٴ�3 min��10 min��v(H2)= mol/(L��min)��
����˵��������Ӧ�ﵽƽ��״̬���� ��ѡ���ţ���
A����Ӧ��CO2��CH3OH�����ʵ���Ũ��֮��Ϊ1�U1����ͼ�н���㣩
B�����������ܶȲ���ʱ��ı仯���仯
C����λʱ����ÿ����3 mol H2��ͬʱ����1 mol H2O
D��CO2����������ڻ�������б��ֲ���
�����д�ʩ����ʹn (CH3OH)/n (CO2)������� ��ѡ���ţ���
A�������¶� B�����º��ݳ���He(g)
C����H2O(g)����ϵ�з��� D�����º����ٳ���1 mol CO2��3 mol H2
 ��ս�п�����ϵ�д�
��ս�п�����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ��2011?���϶�ģ����1����֪���淴Ӧ��M��g��+N��g��
��2011?���϶�ģ����1����֪���淴Ӧ��M��g��+N��g�� P��g��+Q��g������H��0����ش��������⣺
P��g��+Q��g������H��0����ش��������⣺| 1 |
| 2 |
| 1 |
| 2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
| T��K�� | 938 | 1100 |
| K | 0.68 | 0.40 |
| c(CO2) |
| c(CO) |
| c(CO2) |
| c(CO) |
| ���� | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��09��10�긣�ݰ��أ��У��߶���ѧ����ĩ������ѧ�� ���ͣ������
��8�֣��������ȵĻ��������Ź㷺��Ӧ��
��1����֪���淴ӦCl2+H2O HCl+HClO������ˮ�м���NaHCO3�������Һ��HClO��Ũ�� ��������С�����䣩��ԭ���ǣ� ��
HCl+HClO������ˮ�м���NaHCO3�������Һ��HClO��Ũ�� ��������С�����䣩��ԭ���ǣ� ��
��2���ҹ�����������ȷ��������ö����������������������ˮ��������
����ClO2������������ˮ��pHΪ5.5��6.5��������һ���������岻���������������(ClO2��)���������涨������ˮ��ClO 2���ĺ���Ӧ������0.2mg��L��1����pH��2.0ʱ�� ClO2���ܱ�I����ԭ��Cl������д����Ӧ�����ӷ���ʽ ��
2���ĺ���Ӧ������0.2mg��L��1����pH��2.0ʱ�� ClO2���ܱ�I����ԭ��Cl������д����Ӧ�����ӷ���ʽ ��
����ClO2������������ˮ�л����ClO2 ������FeCl2��ClO2��ԭΪCl-���÷�Ӧ������������ ���ѧʽ��������V L(�ѻ���Ϊ��״��)ClO2����һ��������ˮ���ټ���a mol FeCl2�ɽ�������ClO2ǡ�ó�ȥ���������ˮ�в���ClO2�����ʵ���Ϊ mol��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2011-2012ѧ�긣��ʡܼ����У������ѧ�ڵڶ��ο��Ի�ѧ�Ծ��������棩 ���ͣ������
����10�֣�
��1����֪���淴Ӧ��M(g)��N(g) P(g)��Q(g)����H��0����ش��������⣺
P(g)��Q(g)����H��0����ش��������⣺
����Ҫ����M��ת���ʣ��������������������¿��Բ�ȡ�Ĵ�ʩΪ_______________��
A������һ����M B������һ����N C����Ӧ�¶�����
D����С������� E������ij���������� F�������һ����P
����ij�¶��£���Ӧ�����ʼŨ�ȷֱ�Ϊ��c(M)= 1 mol��L��1��c(N)=2.4 mol��L��1���ﵽƽ���M��ת����Ϊ60������ʱN��ת����Ϊ_______________���˷�Ӧ�Ļ�ѧƽ�ⳣ��K��_______________��
������Ӧ�¶Ȳ��䣬��Ӧ�����ʼŨ�ȷֱ�Ϊ��c(M)= 4 mol��L��1��c(N)=a mol��L��1���ﵽƽ���c(P)=2 mol��L��1��a=_______________mol��L��1��
��2�����ſ�ѧ�����Ľ������������Ƴ��˶������͵ļ״����ӽ���Ĥȼ�ϵ�أ������㲻ͬ������
��ͼ��ij�ʼDZ������ü״����ӽ���Ĥȼ�ϵ�صĽṹʾ��ͼ���״��ڴ����������ṩ���Ӻ͵��ӣ�����ת�Ƶķ�������ͼ��ʾ�������Ӿ����·�����Ӿ��ڵ�·������һ����������Ӧ������ܷ�ӦΪ��2CH3OH��3O2===2CO2��4H2O����c�缫�� �������������������c�缫�Ϸ����ĵ缫��ӦʽΪ_____________________________________________��

�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com