
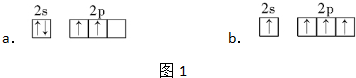
分析 (1)碳原子核外含有6个电子,基态碳原子的价电子排布式为2s22p2,价电子数为4,在2s和2p轨道各含有2个电子;
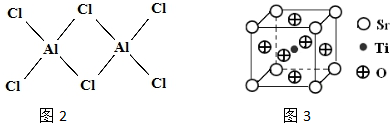
(2)分子晶体的熔沸点较低,氯化铝的熔沸点较低,所以为分子晶体;
氯化铝中铝原子最外层电子只有3个电子,形成3个共价键,每个铝原子和四个氯原子形成共价键,且其中一个共用电子对是氯原子提供形成的配位键;
(3)计算B原子价层电子对数、孤电子对数,确定B原子杂化方式与空间构型;
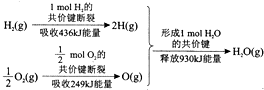
(4)利用均摊法计算晶胞中Sr、Ti、O原子数目,进而确定化学式.
解答 解:(1)基态碳原子的价电子排布式为2s22p2,碳原子的2p和2s轨道各含有2个价电子,其基态原子的价电子排布图为: ,故a符合,
,故a符合,
故答案为:a;
(2)分子晶体的熔沸点较低,氯化铝的熔沸点较低,所以为分子晶体;
氯化铝中铝原子最外层电子只有3个电子,形成3个共价键,每个铝原子和四个氯原子形成共价键,且其中一个共用电子对是氯原子提供形成的配位键,如图 ,
,
故答案为:分子; ;
;
(3)[B(OH)4]-中B的价层电子对=4+$\frac{1}{2}$(3+1-4×1)=4,所以采取sp3杂化,B原子没有孤电子对,为正四面体构型,
故答案为:sp3;正四面体;
(4)晶胞中Sr原子数目为8×1,Ti原子数目为1,O原子数目为6×$\frac{1}{2}$=3,故化学式为SrTiO3,
故答案为:SrTiO3.
点评 本题是对物质结构的考查,涉及核外电子排布、晶体类型与性质、配位键、杂化方式、空间构型、晶胞计算等,需要学生熟练掌握基础知识,难度中等.


科目:高中化学 来源: 题型:多选题
| A. | 此纯净水绝对纯净,不含任何化学物质 | |
| B. | 食用油富含维生素E、油酸、亚油酸,有益于健康 | |
| C. | 八宝粥不含任何糖类物质,请糖尿病患者放心食用 | |
| D. | 低钠盐,为您的健康着想 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 沉淀溶解后,生成深蓝色的配离子为[Cu(NH3)4]2+ | |
| B. | 向反应后的溶液中加入乙醇,有沉淀析出 | |
| C. | 在[Cu(NH3)4]2+离子中,Cu2+提供空轨道,NH3提供孤电子对 | |
| D. | 反应前后,Cu2+浓度不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油裂解得到的汽油是纯净物 | B. | 煤就是碳,属于单质 | ||
| C. | 煤的气化是物理变化过程 | D. | 天然气是一种清洁的化石燃料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molH2(g)的共价键形成放出436kJ能量 | |
| B. | 氢气跟氧气反应生成水的同时吸收能量 | |
| C. | 1molH2(g)跟$\frac{1}{2}$molO2(g)反应生成1molH2O(g)释放能量245kJ | |
| D. | 1molH2(g)与$\frac{1}{2}$molO2(g)的总能量大于1molH2O(g)的能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CSO的电子式: | |
| B. | 甲烷分子的球棍模型: | |
| C. | 2-戊烯的结构简式CH3CH2CHCHCH3 | |
| D. | HCO3-的水解方程式为:HCO3-+H2O?CO32-+H3O+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 序号 | 反应 温度/℃ | c(HCl)/ mol•L-1 | v(HCl) /mL | 碳酸钙的形状 | t/min |
| 1 | 20 | 2 | 10 | 块状 | t1 |
| 2 | 20 | 2 | 10 | 粉末 | t2 |
| 3 | 20 | 4 | 10 | 粉末 | t3 |
| 4 | 40 | 2 | 10 | 粉末 | t4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com