
【题目】在2 L的密闭容器中进行反应:mX(g)+nY(g) == pZ(g)+qQ(g),式中m、n、p、q为化学计量数。在0~2 min内,各物质的物质的量变化如下表所示:
物质 | X | Y | Z | Q |
起始/mol | 0.7 | 1 | ||
2 min末/mol | 0.8 | 2.7[ | 0.8 | 2.7 |
已知2 min内v(Q)=0.075 mol·L-1·min-1,v(Z)∶v(Y)=1∶2。
(1)试确定以下物质的相关量:起始时n(Y)=________,n(Q)=________。
(2)方程式中m=________,n=________,p=________,q=________。
(3)用Z表示2 min内的反应速率为________。
【答案】(1)2.3mol;3.0mol(2)1;4;2;3(3)0.05mol/(L·min)
【解析】
试题分析:2min内v(Q)=0.075molL-1min-1,则△n(Q)=0.075molL-1min-1×2min×2L=0.3mol,根据表中数据可知,2min内X的物质的量变化为:0.8mol-0.7mol=0.1mol,Z的物质的量变化为:1mol - 0.8mol=0.2mol,根据反应速率v(Z):v(Y)=1:2可知,Y的物质的量变化为:△n(Y)=2△n(Z)=0.4mol,反应方程式中物质的量变化与其化学计量数成正比,则:m:n:p:q=0.1mol:0.4mol:0.2mol:0.3mol=1:4:2:3,所以m=1、n=4、p=2、q=3,反应方程式为:X(g)+4Y(g)![]() 2Z(g)+3Q(g)。
2Z(g)+3Q(g)。
(1)2min内生成0.1molX,根据反应X(g)+4Y(g)![]() 2Z(g)+3Q(g)可知,2min内生成Y的物质的量为0.4mol,则起始时Y的物质的量为:2.7mol-0.4mol=2.3mol;Q在2min内物质的量减少,根据反应方程式可知,2min内消耗的Q的物质的量为:0.1mol×3=0.3mol,则起始是Q的物质的量为:2.7mol+0.3mol=3mol;
2Z(g)+3Q(g)可知,2min内生成Y的物质的量为0.4mol,则起始时Y的物质的量为:2.7mol-0.4mol=2.3mol;Q在2min内物质的量减少,根据反应方程式可知,2min内消耗的Q的物质的量为:0.1mol×3=0.3mol,则起始是Q的物质的量为:2.7mol+0.3mol=3mol;
(2)根据以上分析可知,m=1、n=4、p=2、q=3;
(3)2min内消耗的Z的物质的量为:n(Z)=1mol-0.8mol=0.2mol,浓度为0.2mol÷2L=0.1mol/L,则用Z表示2min内的反应速率为:v(Z)=0.1mol/L÷2min==0.05molL-1min-1。


 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案科目:高中化学 来源: 题型:
【题目】工业上利用含镍废料(镍铁钙镁合金为主)制取草酸镍(NiC2O4﹒H2O),再高温煅烧草酸镍制取三氧化二镍。已知草酸的钙、镁、镍盐难溶于水。根据下列工艺流程示意图回答问题。

(1)Fe在元素周期表中的位置 _______________________________
(2)生产过程中多次进行过滤,玻璃棒在过滤操作中的一个作用是引流,下列实验操作中玻璃棒起引流作用的是 (填选项字母)
A.测定Na2CO3溶液的PH
B.配制0.1mol/L 的H2SO4溶液
C.加热NaCl溶液制备NaCl晶体
D.验证Ba(OH)2 · 8H2O与NH4Cl固体反应吸热
(3)①加入H2O2发生的主要反应的离子方程式为_______________________
②加入NH4F后除掉的杂质是_____________________
(4)草酸镍(NiC2O4·2H2O)在热空气中干燥脱水后在高温下煅烧三小时,制得三氧化二镍,同时获得混合气体。无水草酸镍受热分解的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取一定质量的均匀固体混合物Cu、Cu2O和CuO,将其分成两等份,取其中一份用足量的氢气还原,测得反应后固体质量减少3.20g ,另一份加入1000mL稀硝酸,固体恰好完全溶解,且同时收集到标准状况下NO气体2.24L,则所用硝酸的物质的量浓度为
A.0.8mol/L B.1.6mol/L C.0.9mol/L D.1.8mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用密度为1.25g·mL-1,质量分数为36.5%的浓盐酸配制成240mL 0.1mol/L的稀盐酸,请回答:
(1)浓盐酸的物质的量浓度为________mol/L
(2)配制240mL 0.1mol/L的稀盐酸,应选择_________mL的容量瓶,量取浓盐酸的体积为________ml。
(3)完成本实验必需用到的仪器有:量筒、玻璃棒、烧杯、________、容量瓶等
(4)定容时,加水超过了刻度线,应怎样操作:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按照物质的树状分类和交叉分类,HNO3应属于( )
①酸 ②氢化物 ③氧化物 ④含氧酸 ⑤难挥发性酸 ⑥强氧化性酸 ⑦一元酸
⑧化合物
A.①②③④⑤⑥⑦⑧ B.①④⑥⑦⑧
C.①⑧ D.①④⑤⑥⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏伽德罗常数,下列说法不正确的是
A.常温常压下,28gCO和N2混合气体中含有的原子总数为2![]()
B.标准状况下,11.2L的水中含有水分子0.5NA
C.2molOH-中电子数为20NA
D.0.1molFeCl3形成Fe(OH)3胶体,Fe(OH)3胶粒的数目小于0.1![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组探究SO2气体还原Fe3+,他们使用的药品和装置如下图所示,下列说法不合理的是

A.能表明I-的还原性弱于SO2的现象是B中蓝色溶液退色
B.装置C的作用是吸收SO2尾气,防止污染空气
C.为了验证A中发生了氧化还原反应,加入用稀盐酸酸化的BaCl2溶液,产生白色沉淀
D.为了验证A中发生了氧化还原反应,加入KMnO4溶液,紫红色退去
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环戊二烯(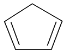 )是一种重要的化工原料,下面是以环戊烷为原料制备环戊二烯的合成路线:
)是一种重要的化工原料,下面是以环戊烷为原料制备环戊二烯的合成路线:
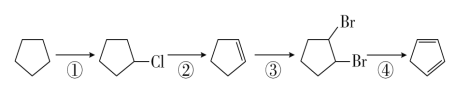
(1)其中,反应①的反应类型是____________,反应②的产物名称是__________。
工业上可由环戊二烯制备金刚烷(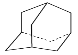 ),途径如下:
),途径如下:
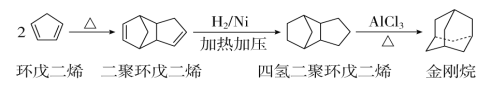
请回答下列问题:
(2)环戊二烯分子中最多有________个原子共平面;
(3)金刚烷的分子式为__________,其分子中的二氯代物有__________种;
(4)A是二聚环戊二烯的同分异构体,属于芳香烃,其苯环上的一氯代物只有二种,能使溴的四氯化碳溶液褪色。符合以上信息的A的所有可能结构(不考虑立体异构)有 种,试写出苯环上支链最多的几种同分异构体的结构简式:_________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com