
 甲、乙两个实验小组利用KMnO4酸性溶液与H2C2O4溶液反应研究影响反应速率的因素.
甲、乙两个实验小组利用KMnO4酸性溶液与H2C2O4溶液反应研究影响反应速率的因素.| 序号 | A溶液 | B溶液 |
| ① | 2mL 0.1mol/L H2C2O4溶液 | 4mL 0.01mol/L KMnO4溶液 |
| ② | 2mL 0.2mol/L H2C2O4溶液 | 4mL 0.01mol/L KMnO4溶液 |
| ③ | 2mL 0.2mol/L H2C2O4溶液 | 4mL 0.01mol/L KMnO4溶液和少量MnSO4 |


 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源: 题型:
| A、5 | B、3 | C、2 | D、1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Al3+、Na+、NO3-、Cl- |
| B、K+、Na+、Cl-、SO42- |
| C、K+、Na+、Cl-、CO32- |
| D、K+、I-、NO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaCl和KI |
| B、NaCl和I2 |
| C、KCl和NaBr |
| D、KCl和I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 金属 | Na | Al | Cu | Fe |
| 熔点(℃) | 97.81 | 660 | 1083 | 1535 |
| 沸点(℃) | 883 | 2200 | 2595 | 3000 |
| A、Fe-Cu合金 |
| B、Cu-Al合金 |
| C、Al-Na合金 |
| D、Cu-Na合金 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 氢的存储是氢能应用的主要瓶颈,目前所采用或正在研究的主要储氢材料有:配位氢化物、富氢载体化合物、碳质材料、金属氢化物等.
氢的存储是氢能应用的主要瓶颈,目前所采用或正在研究的主要储氢材料有:配位氢化物、富氢载体化合物、碳质材料、金属氢化物等.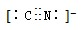
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 需加入的试剂 | 分离装置 | |
| 苯(乙醇) | ||
| 乙烷(乙烯) | ||
| 乙醇(乙酸) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、生成物的总能量大于反应物的总能量 |
| B、该反应为放热反应 |
| C、该反应中每4 mol NH3(g)被氧化,吸收905 kJ热量 |
| D、该反应为吸热反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com