
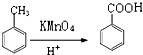
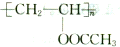 ,D→E的反应类型是取代反应.
,D→E的反应类型是取代反应. .
. .
. (写结构简式)
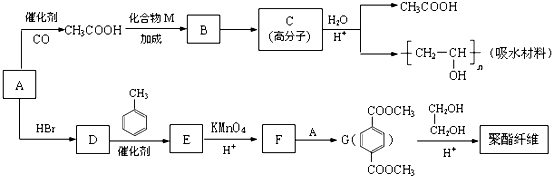
(写结构简式)分析 有机物A能与Na反应,相对分子质量为32,所以A是甲醇,甲醇和CO发生加成反应生成乙酸,乙酸和M发生加成反应生成B,B反应生成C,C在酸性条件下水解生成乙酸和聚乙烯醇,则C的结构简式为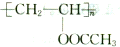 ,所以B是乙酸乙烯酯,结构简式为CH3COOCH=CH2,乙酸和M发生加成反应生成B,则M是HC≡CH.甲醇和氢溴酸反应生成D为一溴甲烷,F和甲醇发生酯化反应生成G,根据G的结构简式知F的结构简式为:
,所以B是乙酸乙烯酯,结构简式为CH3COOCH=CH2,乙酸和M发生加成反应生成B,则M是HC≡CH.甲醇和氢溴酸反应生成D为一溴甲烷,F和甲醇发生酯化反应生成G,根据G的结构简式知F的结构简式为: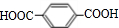 ,E发生氧化反应生成F,一溴甲烷和甲苯发生取代反应生成E为
,E发生氧化反应生成F,一溴甲烷和甲苯发生取代反应生成E为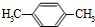 .
.
解答 解:有机物A能与Na反应,相对分子质量为32,所以A是甲醇,甲醇和CO发生加成反应生成乙酸,乙酸和M发生加成反应生成B,B反应生成C,C在酸性条件下水解生成乙酸和聚乙烯醇,则C的结构简式为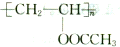 ,所以B是乙酸乙烯酯,结构简式为CH3COOCH=CH2,乙酸和M发生加成反应生成B,则M是HC≡CH.甲醇和氢溴酸反应生成D为一溴甲烷,F和甲醇发生酯化反应生成G,根据G的结构简式知F的结构简式为:
,所以B是乙酸乙烯酯,结构简式为CH3COOCH=CH2,乙酸和M发生加成反应生成B,则M是HC≡CH.甲醇和氢溴酸反应生成D为一溴甲烷,F和甲醇发生酯化反应生成G,根据G的结构简式知F的结构简式为: ,E发生氧化反应生成F,一溴甲烷和甲苯发生取代反应生成E为
,E发生氧化反应生成F,一溴甲烷和甲苯发生取代反应生成E为 .
.
(1)A为甲醇,结构简式为CH3OH,B为CH3COOCH=CH2,含氧官能团是:酯基,
故答案为:CH3OH;酯基;
(2)C的结构简式为: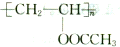 ,D→E的反应类型是取代反应,
,D→E的反应类型是取代反应,
故答案为: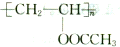 ;取代反应;
;取代反应;
(3)F+A→G的化学方程式是: ,
,
故答案为: ;
;
(4)CH3COOH+CH≡CH→B的化学方程式是:HC≡CH+CH3COOH$\stackrel{一定条件}{→}$CH3COOCH=CH2,
故答案为:HC≡CH+CH3COOH$\stackrel{一定条件}{→}$CH3COOCH=CH2;
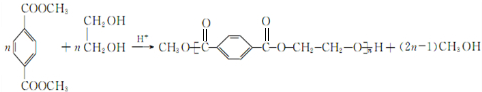
(5)G发生信息中酯交换生成聚酯纤维,反应化学方程式是: ,
,
故答案为: ;
;
(6)G(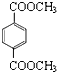 )的同分异构体满足下列条件:①苯环上只有两个取代基,②1mol与足量的NaHCO3溶液反应生成2molCO2气体,含有2个-COOH,两个取代基为-COOH、-CH2CH2COOH,或者为-COOH、-CH(CH3)COOH,或者为-CH2COOH、-CH2COOH,或者为-CH3、-CH(COOH)2,各有邻、间、对3种,故共有12种,其中核磁共振氢谱显示3组峰的是
)的同分异构体满足下列条件:①苯环上只有两个取代基,②1mol与足量的NaHCO3溶液反应生成2molCO2气体,含有2个-COOH,两个取代基为-COOH、-CH2CH2COOH,或者为-COOH、-CH(CH3)COOH,或者为-CH2COOH、-CH2COOH,或者为-CH3、-CH(COOH)2,各有邻、间、对3种,故共有12种,其中核磁共振氢谱显示3组峰的是 ,
,
故答案为:12; .
.
点评 本题考查有机物推断与合成,根据有机物结构与给予的信息采取正、逆推法相结合进行推断,较好的考查学生分析推理能力,熟练掌握官能团的性质与转化.


科目:高中化学 来源: 题型:解答题
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、K+、Cl?、NO3? | B. | K+、Na+、ClO?、SO42- | ||
| C. | Al3+、Cu2+、Cl?、S2- | D. | Na+、Fe2+、NO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 红宝石、玛瑙、水晶、钻石等装饰品的主要成分都不相同 | |
| B. | 将Al2(SO4)3溶液蒸干、灼烧至恒重,最终剩余固体是Al2O3 | |
| C. | 白磷、臭氧、碳-60、氩、水等物质都是由分子构成的,分子内都存在共价键 | |
| D. | 工业生产玻璃、水泥、漂白粉,均需要用石灰石为原料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,0.1mol•L-1的碳酸钠溶液中含有的阴离子数大于0.1NA | |
| B. | 标况下33.6mL氯气通入足量水中发生反应,转移电子数为1.5×10-3NA | |
| C. | 常温常压下,28克由C3H6和C4H8组成的混合气体中含共用电子对数目为6NA个 | |
| D. | 同温下,pH=1体积为1L的硫酸溶液所含氢离子数与pH=13体积为1L的氢氧化钠溶液所含氢氧根离子数均为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | A | B | C | D |
| 装置 | 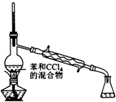 | 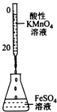 | 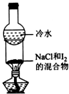 | 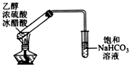 |
| 实验目的 | 分离苯和CCl4 | 酸性KmnO4溶液滴定FeSO4溶液 | 除去NaCl中的I2 | 制备和收集少量乙酸乙酯 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
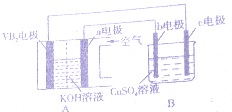 碱性硼化钒(VB2),-空气电池工作时反应为:4VB2+1lO2=4B203+2V205.用该电池为电源,选用惰性电极电解硫酸铜溶液,实验装置如图所示.当外电路中通过0.04mol电子时,B装置内共收集到 0.448L气体(标推状况)下列说法正确的是( )
碱性硼化钒(VB2),-空气电池工作时反应为:4VB2+1lO2=4B203+2V205.用该电池为电源,选用惰性电极电解硫酸铜溶液,实验装置如图所示.当外电路中通过0.04mol电子时,B装置内共收集到 0.448L气体(标推状况)下列说法正确的是( )| A. | VB2电极发生的电极反应为:2VB2+11H20-22e-═V205+2B203+22H+ | |
| B. | 若B装置内液体的体积一直为200mL,则原CuS04溶液浓度为0.05 mol/L | |
| C. | 电解过程中,b电极表面先有红色物质析出,然后有气泡产生 | |
| D. | 外电路中电子由c电极流向VB2电极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 生成CaCO3 | 溶液中HCO3- | H2 | 转移的电子 | |
| A | 0.1NA | 0.1NA | ||
| B | 1.12L | 0.1NA | ||
| C | 10g | 0.05NA | ||
| D | 10g | 0.1NA |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com