
 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源:2013届福建安溪一中、养正中学高三上学期期中联考化学试卷(带解析) 题型:填空题
(10分)(I)锌和铝都是活泼金属,其氢氧化物既能溶于强酸,又能溶于强碱。但是氢氧化铝不溶于氨水,氢氧化锌溶于氨水可以生成Zn(NH3)42+。回答下列问题:
(1)写出锌和氢氧化钠溶液反应的化学方程式 。
(2)写出可溶性铝盐与过量氨水反应的离子方程式 。
试解释在实验室不适宜用可溶性锌盐与氨水反应制备氢氧化锌的原因 。
(II)环境专家认为可以用金属镁将水体中的NO 转化为N2,从而清除污染。该反应中涉及的粒子有:H2O、Mg、OH
转化为N2,从而清除污染。该反应中涉及的粒子有:H2O、Mg、OH 、Mg(OH)2、NO
、Mg(OH)2、NO 、N2,请将各粒子分别填入以下空格内(不用配平)。
、N2,请将各粒子分别填入以下空格内(不用配平)。
该反应过程中,被氧化与被还原的元素的物质的量之比为 。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年福建安溪一中、养正中学高三上学期期中联考化学试卷(解析版) 题型:填空题
(10分)(I)锌和铝都是活泼金属,其氢氧化物既能溶于强酸,又能溶于强碱。但是氢氧化铝不溶于氨水,氢氧化锌溶于氨水可以生成Zn(NH3)42+。回答下列问题:
(1)写出锌和氢氧化钠溶液反应的化学方程式 。
(2)写出可溶性铝盐与过量氨水反应的离子方程式 。
试解释在实验室不适宜用可溶性锌盐与氨水反应制备氢氧化锌的原因 。
(II)环境专家认为可以用金属镁将水体中的NO 转化为N2,从而清除污染。该反应中涉及的粒子有:H2O、Mg、OH
转化为N2,从而清除污染。该反应中涉及的粒子有:H2O、Mg、OH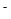 、Mg(OH)2、NO
、Mg(OH)2、NO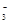 、N2,请将各粒子分别填入以下空格内(不用配平)。
、N2,请将各粒子分别填入以下空格内(不用配平)。

该反应过程中,被氧化与被还原的元素的物质的量之比为 。
查看答案和解析>>
科目:高中化学 来源:同步题 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com