
| A. | 第七周期ⅣA族 | B. | 第七周期ⅡA族 | C. | 第七周期ⅡB族 | D. | 第六周期ⅥA族 |
 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:解答题
 某校课外活动小组为了探究铜与稀硝酸反应产生的气体主要是NO而设计了下列实验,装置如图所示(加热装置和固定装置均已略去).图中K为止水夹(处于关闭状态),F是一半空的注射器.
某校课外活动小组为了探究铜与稀硝酸反应产生的气体主要是NO而设计了下列实验,装置如图所示(加热装置和固定装置均已略去).图中K为止水夹(处于关闭状态),F是一半空的注射器.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 操作 | 现象 | 结论 |
| A | 向10mL 1mol/LNaOH溶液中先加入3滴1mol/LMgCl2溶液,再加入3滴1mol/LFeCl3溶液 | 现有白色沉淀,后为红褐色沉淀 | Mg(OH)2转化为Fe(OH)3 |
| B | 向某氯化亚铁溶液中,加入Na2O2粉末 | 出现红褐色沉淀 | 说明原氯化亚铁已氧化变质 |
| C | 向溶液X中加入稀盐酸,并将产生的无色气体通入澄清石灰水中 | 有白色沉淀生成 | 溶液X中一定含有CO32-或HCO3- |
| D | 向25mL冷水和沸水中分别滴入5滴FeCl3饱和溶液 | 前者为黄色沉淀,后者为红褐色液体 | 温度升高,Fe3+的水解程度增大 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业生产硫酸时,使用热交换器可以充分利用反应中所放出的热量 | |
| B. | 工业上合成氨没有采用更大的压强是从设备和动力要求方面考虑的 | |
| C. | 工业上用离子交换膜法电解饱和食盐水制烧碱 | |
| D. | 工业上采用电解(省电能30%)的AlCl3-KCl熔融体的方法制取金属铝 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
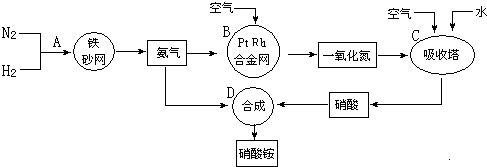
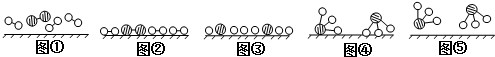
 、
、 、
、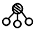 分别表示N2、H2、NH3.图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是N2、H2被吸附在催化剂表面、在催化剂表面N2、H2中的化学键断裂.
分别表示N2、H2、NH3.图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是N2、H2被吸附在催化剂表面、在催化剂表面N2、H2中的化学键断裂.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | 不纯物 | 除杂试剂 | 分离方法 |
| A | CH4(C2H4) | 酸性KMnO4溶液 | 洗气 |
| B | 苯(苯酚) | 溴水 | 过滤 |
| C | 乙酸乙酯(乙酸) | NaOH溶液 | 蒸馏 |
| D | 苯(苯酚) | NaOH溶液 | 分液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素相对原子质量依次递增 | |
| B. | 元素原子半径呈周期性变化 | |
| C. | 元素原子核外电子排布呈周期性变化 | |
| D. | 元素金属性或非金属性呈周期性变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
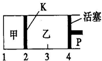 一定温度下可逆反应A(s)+2B(g)?2C(g)+D(g)△H<0.现将1molA和2molB加入甲容器中,将4molC和2molD加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,t1时两容器内均达到平衡状态(如图所示,隔板K不能移动).下列说法正确的是( )
一定温度下可逆反应A(s)+2B(g)?2C(g)+D(g)△H<0.现将1molA和2molB加入甲容器中,将4molC和2molD加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,t1时两容器内均达到平衡状态(如图所示,隔板K不能移动).下列说法正确的是( )| A. | 保持温度和活塞位置不变,在甲中再加入1mol A和2mol B,达到新的平衡后,甲中C的浓度是乙中C的浓度的2倍 | |
| B. | 保持温度和乙中的压强不变,分别向甲、乙中加入等质量的氦气后,甲中平衡不移动,乙中平衡向正反应方向移动 | |
| C. | 保持活塞位置不变,升高温度,达到新的平衡后,甲、乙中B的体积分数均减小 | |
| D. | 保持温度不变,移动活塞P,使乙的容积和甲相等,达到新的平衡后,乙中C的体积分数是甲中C的体积分数的2倍 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com