
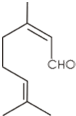
| A、1 mol香叶醛发生加成反应需要2 mol H2 |
| B、香叶醛不能与溴发生反应 |
| C、香叶醛能与钠发生反应生成H2 |
| D、香叶醛能发生银镜反应 |


科目:高中化学 来源: 题型:
| A、60克SiO2含有2NA个Si-O共价键 |
| B、1.0L 1.0mo1/L的NaAlO2水溶液中含有的氧原子数为2NA |
| C、8.2g Na218O2与足量的CO2和H2O(g)的混合气体充分反应后转移电子数为0.1NA |
| D、NA个Fe(OH)3胶体粒子的质量为107g |
查看答案和解析>>
科目:高中化学 来源: 题型:
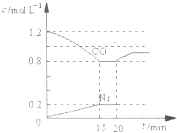
| A、测定时,v正>v逆 |
| B、测定时,v正<v逆 |
| C、测定时,v正=v逆 |
| D、不可能达到新平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加入NaOH固体 |
| B、加入NaCl固体 |
| C、加入CH3COOH固体 |
| D、升温 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向水中加入稀氨水,平衡逆向移动,c(OH-)降低 |
| B、向水中加入少量固体硫酸氢钠,c(H-)降低 |
| C、向水中加入少量固体氢氧化钠,平衡正向移动,c(H-)降低 |
| D、将水加热,KW增大,pH不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、气体A为二氧化硫和氢气的混合物 |
| B、气体A中二氧化硫和氢气的体积比为4:1 |
| C、反应中共消耗锌95.5g |
| D、反应中共转移电子1.5mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原子半径逐渐减小 |
| B、元素的金属性逐渐增强 |
| C、最高正化合价逐渐增大 |
| D、单质的熔沸点逐渐降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 已知B是一种由三种短周期(各位于不同周期)元素组成的正盐,该盐在常用锌锰干电池中做电解质:Y在常温下为液态,E的相同对分子质量比D大16,它们存在如下转化关系(反应条件及部分产物已略去);
已知B是一种由三种短周期(各位于不同周期)元素组成的正盐,该盐在常用锌锰干电池中做电解质:Y在常温下为液态,E的相同对分子质量比D大16,它们存在如下转化关系(反应条件及部分产物已略去);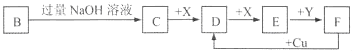
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com