
氨是最重要的化工产品之一,其生产方法也在逐渐改进中,各国科学家均在为提高氨的产量,降低能耗做各种有益的探究; 氨在工业上有广泛用途。
(1)合成氨用的 H2 可以 CH4 为原料制得。已知相关的化学键键能数据如下:
则 CH4(g)与 H2O(g)反应生成 CO(g)和 H2(g)的热化学方程式 。
(2)近年有人将电磁场直接加在氮气与氢气反应的容器内,在较低的温度和压强条件下合成氨,获得了 较好的产率。从化学反应本质角度分析,电磁场对合成氨反应的作用是 。
(3)在 425℃、A12O3 作催化剂,甲醇与氨气反应可以制得(CH3)2NH。(CH3)2NH 显弱碱性,与盐酸反应 生成(CH3)2NH2Cl ,溶液中各离子浓度由小到大的顺序为 。
(4)直接供氨式碱性燃料电池的电池反应式 4NH3 + 3O2 = 2N2+ 6H2O,负极电极反应式为 。
(5)如下图,采用 NH3 作还原剂,烟气以一定的流速通过两种不同催化剂,测量逸出气体中氮氧化物含 量,从而确定烟气脱氮率,反应原理为:NO(g) +NO2(g)+2NH3(g) 2N2(g) + 3H2O(g)。(注:脱氮率即氮氧化物转化率)
2N2(g) + 3H2O(g)。(注:脱氮率即氮氧化物转化率)
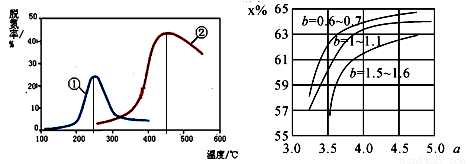
①对于气相反应,用某组分(B)的平衡压强(pB)代替物质的量浓度(cB)也 可以表示平衡常数(记作 KP),则上述反应的 KP=_______。
②以下说法正确的是________。
A.上述反应的正反应为吸热反应。
B.相同条件下,改变压强对脱氮率没有影响。
C.催化剂①、②分别适合于 250℃和 450℃左右脱氮
D.曲线①、②最高点表示此时平衡转化率最高
(6)氨气制取尿素[CO(NH2)2]的合成塔中发生反应:2NH3(g)+CO2(g) CO(NH2)2(l)+H2O(g)。下图 为合成塔中不同氨碳比 a [n(NH3)/n(CO2)] 和水碳比 b [n(H2O)/n(CO2)]时二氧化碳转化率(x%)。b 宜控制在__________(填序号)范围内
CO(NH2)2(l)+H2O(g)。下图 为合成塔中不同氨碳比 a [n(NH3)/n(CO2)] 和水碳比 b [n(H2O)/n(CO2)]时二氧化碳转化率(x%)。b 宜控制在__________(填序号)范围内
A.0.6~0.7 B.1~1.1 C.1.5~1.6
a 宜控制在 4.0 左右,理由是___________。
(7)氨氧化法制硝酸工业中,可用尿素溶液除去尾气中氮氧化物(NO 和 NO2)。尾气中的 NO、NO2 与 水反应生成亚硝酸,亚硝酸再与尿素反应生成对大气无污染的气体。1 mol 尿素能吸收工业尾气中氮氧化 物(假设 NO、NO2 体积比为 1:1)的质量为 g。
科目:高中化学 来源:2016-2017学年江苏省苏州市高二上学期学业模拟三化学试卷(解析版) 题型:选择题
下列反应的离子方程式中,书写正确的是
A.碳酸氢钠溶液与氢氧化钠溶液反应:H++OH-=H2O
B.铝与烧碱溶液反应:Al+2H2O+OH-=AlO2-+ 2H2↑
C.碳酸钙溶于醋酸中:CaCO3+2H+=Ca2++H2O+CO2↑
D.向偏铝酸钠溶液中通入少量CO2:2AlO2-+CO2+3H2O=2Al(OH)3↓+ CO32-
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广西省钦州市钦州港区高一12月月考化学卷(解析版) 题型:选择题
下表各组物质之间通过一步反应不可以实现如下图所示转化关系的是
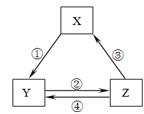
选项 | X | Y | Z | 箭头上所标数字的反应条件 |
A | Na2O2 | NaOH | NaCl | ①常温遇水 |
B | AlCl3 | NaAlO2 |
| ②通入CO2 |
C | NO | NO2 | HNO3 | ④加入铜粉 |
D | Cl2 | NaClO | HClO | ③加浓盐酸 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广西省钦州市高新区高一12月月考化学试卷(解析版) 题型:选择题
在一定条件下,分别以高锰酸钾、氯酸钾、过氧化氢为原料制取氧气,当三个反应中转移的电子个数之比为9:3:8 时,在同温同压下三个反应中所制得氧气体积之比为( )
A.4:3:2 B.9:3:16 C.2:2:1 D.9:3:8
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广西省钦州市高新区高一12月月考化学试卷(解析版) 题型:选择题
从某些性质看,NH 3 与H  2 O相当,NH 4 + 与H 3 O + ,NH 2 -与OH- 都有相当关系,下列有关方程式不正确的是 ( )
2 O相当,NH 4 + 与H 3 O + ,NH 2 -与OH- 都有相当关系,下列有关方程式不正确的是 ( )
A.NH4Cl+KNH2=KCl+2NH3↑
B.M+2NH3=M(NH2)2+H2↑(M为二价活泼金属)
C.2NH4Cl+MNH2=MCl2+NH3
D.2NH4Cl+MO=M(NH2)2+2HCl+H2O
查看答案和解析>>
科目:高中化学 来源:2017届四川省广元市高三上学期一诊化学试卷(解析版) 题型:选择题
锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过,下列有关叙述正确的是
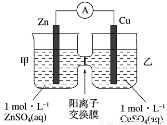
A.锌电极上发生还原反应
B.电池工作一段时间后,甲池的 c(SO42-)不变
C.电池工作一段时间后,乙池溶液的总质量减少
D.阴阳离子分别通过交换膜向负极和正极移动,保持溶液中电荷平衡
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江哈尔滨六中高二上期末化学卷(解析版) 题型:填空题
(1)常温下将0.2 mol/LHCl溶液与0.2 mol/LMOH溶液等体积混合,测得混合溶液的pH=6,则混合溶液中由水电离出的c(H+)__________0.2 mol/LHCl溶液中由水电离出的c(H+)。(填“>”“<”或“=”),该混合溶液的物料守恒式为 。
(2)常温下若将0.2 mol/LMOH溶液与0.1 mol/LHCl溶液等体积混合,测得混合溶液的pH<7,则说明在相同条件下MOH的电离程度__________MCl的水解程度。(填“>”“<”或“=”)
(3)常温下若将pH=3的HR溶液与pH=11的NaOH溶液等体积混合,测得混合溶液的pH≠7,则混合溶液的pH__________。(填“>7”“<7”或“无法确定”)
(4)纯碱溶液呈碱性的原因(用离子方程式表示)__________________________,纯碱溶液离子浓度由大到小的顺序为 。
(5)某温度时,测得0.01 mol/L的NaOH溶液pH为11,在此温度下,将pH=a的NaOH溶液Va L与pH=b的硫酸Vb L混合。若所得混合溶液为中性,且a=12,b=2,求Va ∶Vb = 。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江哈尔滨六中高二上期末化学卷(解析版) 题型:选择题
为了检验某FeCl2溶液是否变质,可选用的试剂是( )
A. K3[Fe(CN)6]溶液 B. 石蕊试液 C. KSCN溶液 D. 酸性KMnO4溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com