
����Ŀ������(N2H4)�ʹ�������(NaH2PO2)������ǿ��ԭ��.�����Ź㷺����;��
(1)��֪:��N2H4(l)+O2(g)=N2(g)+2H2O(g) ��H=-621.5 kJ��mol-1
��N2O4(l)-=N2(g)+2O2(g) ��H2=+204.3 kJ��mol-1
����ȼ�ϵ�ȼ�շ�ӦΪ2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g) ��H=_____.
(2)��֪��ӦN2H4(g)+ 2Cl2(g)![]() N2(g)+4HCl(g),T��Cʱ,��V L�����ܱ������м���2 mol N2H4(g)��4 mol Cl2(g) ,���Cl2��HCl��Ũ����ʱ��Ĺ�ϵ��ͼ��ʾ��
N2(g)+4HCl(g),T��Cʱ,��V L�����ܱ������м���2 mol N2H4(g)��4 mol Cl2(g) ,���Cl2��HCl��Ũ����ʱ��Ĺ�ϵ��ͼ��ʾ��

��0~ 10 min��,��N2(g)��ʾ��ƽ����Ӧ����v(N2)=_______��
��M��ʱ,N2H4��ת����Ϊ______(��ȷ��0.1)%��
��T ��Cʱ,�ﵽƽ�������������м���1.2 mol N2H4(g)��0.4 mol Cl2(g)��0. 8 mol N2 (g)��1.2 mol HCl(g) ,��ʱƽ��______(���������ƶ����������ƶ����������ƶ���)��
(3)���ڶ���������,������(P4)��ʯ�����̼������Һһͬ��������黯��Ӧ�����Ƶ�NaH2PO2,ͬʱ����������(PH3)����,�÷�Ӧ�Ļ�ѧ����ʽΪ________________��
�ڴ�����(H3PO2)��һԪ�ᣬ������.1.0 mol��L-1��NaH2PO2��ҺpHΪ8,��������Ka=___________��
���ô�������ͨ�����������Ʊ�������.װ����ͼ2��ʾ������ĤA����____(������������������������)����Ĥ,�缫N�ĵ缫��ӦʽΪ______,����·������3.8528��105���ص���ʱ.�Ƶô���������ʵ���Ϊ_____ (һ�����ӵĵ���Ϊ 1.6��10- 19����,NA��ֵԼΪ6. 02�� 1023)��

���𰸡�-1038.7kJmol-1 0.06mol/(Lmin) 33.3 �����ƶ� 2P4+3Ca(OH)2+3Na2CO3+6H2O==== 6NaH2PO2+2PH3��+3CaCO3 1.0��10-2 ������ 2H2O+2e-=H2��+2OH- 4mol
��������
(1)���ݸ�˹���ɣ���Ӧ����2+�ڼ��ɵû��ȼ�ϵ�ȼ�շ�Ӧ2N2H4(1)+N2O4(l)===3N2(g)+4H2O(g)��H=(-621.5��2+204.3)kJmol-1=-1038.7kJmol-1��
(2)����ͼʾ��Cl2��Ϊ��Ӧ��Ũ�����С��HCl��Ϊ������Ũ��������
�١�c(Cl2)=(2-0.8)mol/L=1.2mol/L��v(Cl2)=![]() =0.12mol/(Lmin)�����ݷ�Ӧ���������ϵ�������ȿɵ�v(N2)=
=0.12mol/(Lmin)�����ݷ�Ӧ���������ϵ�������ȿɵ�v(N2)=![]() v(Cl2)=0.06mol/(Lmin)��
v(Cl2)=0.06mol/(Lmin)��
�ھ�ͼ��֪��Ӧ��ʼʱc(Cl2)=2mol/L��Ͷ��Ϊ2 mol N2H4(g)��4 mol Cl2(g) ����ʼʱc(N2H4)=1mol/L���������Ϊ2L����M�� N2H4��ת����Ϊx mol/L��������ʽ��
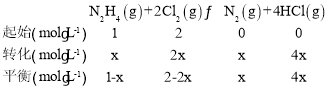
M��Cl2��HCl��Ũ����ȣ���2-2x=4x���x=![]() mol/L����N2H4��ת����Ϊ
mol/L����N2H4��ת����Ϊ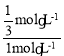 =33.3%��
=33.3%��
�۾�ͼ��֪��Ӧƽ��ʱc(Cl2)=0.8mol/L����ʼc(Cl2)=2mol/L��c(N2H4)=1mol/L������ݷ�Ӧ����ʽN2H4(g)+ 2Cl2(g)![]() N2(g)+4HCl(g)��֪����Ӧ������c(Cl2)=1.2mol/L������c(N2H4)=0.6mol/L������c(N2)=0.6mol/L��c(HCl)=2.4mol/L������ƽ��ʱ�����ʵ�Ũ��Ϊc(Cl2)=0.8mol/L��c(N2H4)=0.4mol/L��c(N2)=0.6mol/L��c(HCl)=2.4mol/L������¶��µ�ƽ�ⳣ��K=
N2(g)+4HCl(g)��֪����Ӧ������c(Cl2)=1.2mol/L������c(N2H4)=0.6mol/L������c(N2)=0.6mol/L��c(HCl)=2.4mol/L������ƽ��ʱ�����ʵ�Ũ��Ϊc(Cl2)=0.8mol/L��c(N2H4)=0.4mol/L��c(N2)=0.6mol/L��c(HCl)=2.4mol/L������¶��µ�ƽ�ⳣ��K=![]() =77.76��
=77.76��
ƽ�������������м���1.2molN2H4(g)��0.4 mol Cl2(g)��0.8molN2(g)��1.2molHCl(g)�������ʵ�Ũ�ȱ�Ϊc(Cl2)=1mol/L��c(N2H4)=1mol/L��c(N2)=1mol/L��c(HCl)=3mol/L����ʱQc=![]() =81>K������ƽ�������ƶ���
=81>K������ƽ�������ƶ���
(3)�ٸ÷�Ӧ�з�Ӧ����P4��Ca(OH)2��Na2CO3�ȡ���������NaH2PO2��PH3�ȣ��ݴ˿�֪�÷�Ӧ��PԪ�ػ��ϼۼ������ֽ��ͣ������绯������1�ۣ�����3�ۣ���NaH2PO2��PH3��ϵ����Ϊ3��1���ٽ��Ԫ���غ��֪����ʽΪ��2P4+3Ca(OH)2+3Na2CO3+6H2O==== 6NaH2PO2+2PH3��+3CaCO3��
�ڴ�����(H3PO2)��һԪ�ᣬ1.0molL-1�� NaH2PO2��Һˮ�ⷽ��ʽΪ��H2PO2-+H2O=H3PO2![]() =1.0��10-2��
=1.0��10-2��
�۸���ͼʾ��֪����Ʒ�Ҳ��������ᣬ��缫MӦΪ�������ˮ�е�OH-��ʣ��H+ͨ������ĤA�����Ʒ�ң����Խ���ĤAΪ�����ӽ���Ĥ���缫NΪ�������H+���缫N�ĵ缫��ӦʽΪ2H2O+2e-=H2��+2OH-����·������3.8528��105���ص���ʱ��ת�Ƶĵ��ӵ����ʵ���Ϊ![]() =4mol�����������һ������ɣ������Ӵ�һ������ɣ����Ե�������ת��1mol��������1mol�����ᣬ��ת��4mol����ʱ����4mol�����ᡣ
=4mol�����������һ������ɣ������Ӵ�һ������ɣ����Ե�������ת��1mol��������1mol�����ᣬ��ת��4mol����ʱ����4mol�����ᡣ



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��þ���仯����һ����(��Ͷ�)������Ⱦ����þԭ��طŵ�ʱ��ѹ�߶�ƽ�ȣ�ʹþԭ���Խ��Խ��Ϊ����������ɫԭ��صĹ�ע���㡣����һ��þԭ��صķ�ӦΪxMg��Mo3S4![]() MgxMo3S4������˵����ȷ����( )
MgxMo3S4������˵����ȷ����( )
A����س��ʱ������������ԭ��Ӧ����Mo3S4
B����س��ʱ��������ӦΪxMg��2xe��===xMg2��
C����طŵ�ʱ��Mg2����Ǩ��
D����طŵ�ʱ��������ӦΪMo3S4��2xe����xMg2��=== MgxMo3S4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NA��ʾ�����ӵ�������ֵ������˵����ȷ���ǣ�������
A. ��״���£�22.4 L�����к���2NA������
B. 0.1NA���Ȼ������ռ�����Ϊ2.24 L
C. 2�˽����Ʊ�ɸ�����ʱʧȥ�ĵ�����Ϊ0.1NA
D. 50 mL 0.1 mol��L-1H2SO4��Һ�к���H+��Ϊ0.005NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ӹ����������仯��������������������ж����˾�����á�
��1���Ŵ��й��Ĵ���֮һ��ָ����������Ȼ��ʯ�Ƴɵģ�����Ҫ�ɷ���_________________��
A��Fe B��FeO C��Fe3O4 D��Fe2O3
��2�����ִ����������У�������FeCl3��ʴͭ��ԭ������ӡˢ��·�壬д����ԭ���Ļ�ѧ����ʽ_________________________________��
��3��ʵ�������̷�FeSO4��xH2O����FeSO4��ҺʱΪ�˷�ֹFeSO4��Һ���ʣ����������м������ۣ���ԭ����_____________________ (�����ӷ���ʽ��ʾ)��
��4��ijͬѧ��ȡ2 mL FeSO4��Һ������1��KSCN��Һ���ټ��뼸����ˮ����Һ��죬˵��Cl2�ɽ�Fe2���������̷���Һ����ˮ��Ӧ�����ӷ���ʽΪ_______��
��5��ͬѧ����Ϊ��ͬѧ��ʵ�鲻���Ͻ�����ͬѧ��2 mL FeSO4 ��Һ���ȼ���0.5 mLú�ͣ�����Һ�������μ���1��KSCN��Һ�ͼ�����ˮ����Һ��죬ú�͵�������_____________��
��6��Ϊ�ⶨij�̷�FeSO4��xH2O�нᾧˮ��������ʯӢ�����ܣ������˿���K1��K2������Ϊװ��A�����أ���Ϊm1 g������Ʒװ��ʯӢ�������У��ٴν�װ��A���أ���Ϊ m2 g������ͼ���Ӻ�װ�ý���ʵ�飺

������B��������____________��
�ڽ�����ʵ�����������ȷ����__________�����ţ����ظ������������裬ֱ��A���أ���Ϊm3 g��
a����ȼ�ƾ��ƣ�����
b��Ϩ��ƾ���
c���ر�K1��K2
d����K1��K2������ͨ��N2
e������A
f����ȴ������
�۸���ʵ���¼�������̷�FeSO4��xH2O��ѧʽ�нᾧˮ��Ŀx=_______________________����ʽ��ʾ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Һ��������Ҫ�ɷ�֮һ�Ƕ��飬��10kg������ȫȼ�ղ����ɶ�����̼��Һ̬ˮʱ���ų�����Ϊ5��105kJ����д������ȼ�յ��Ȼ�ѧ����ʽ____________________����֪1molҺ̬ˮ����ʱ��Ҫ����44kJ����������Ӧ![]() ����HΪ____________________��
����HΪ____________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���û���̿��ԭ��������������йط�ӦΪ��C(s)+ 2NO��g��![]() N2��g��+ CO2��g����ij�о�С����ij�ܱյ������������������������䣬��������������Բ��ƣ��м���NO�������Ļ���̿�����£�T1�棩�����·�Ӧ����Ӧ���е���ͬʱ���ø����ʵ�Ũ�����£�
N2��g��+ CO2��g����ij�о�С����ij�ܱյ������������������������䣬��������������Բ��ƣ��м���NO�������Ļ���̿�����£�T1�棩�����·�Ӧ����Ӧ���е���ͬʱ���ø����ʵ�Ũ�����£�
ʱ��min/ Ũ��mol��L-1 | NO | N2 | CO2 |
0 | 1.00 | 0 | 0 |
10 | 0.58 | 0.21 | 0.21 |
20 | 0.40 | 0.30 | 0.30 |
30 | 0.40 | 0.30 | 0.30 |
40 | 0.32 | 0.34 | 0.17 |
50 | 0.32 | 0.34 | 0.17 |
��1�� 10 min��20 min��ʱ����ڣ���CO2��ʾ�ķ�Ӧ����Ϊ____��
��2��������÷�Ӧ��ƽ�ⳣ����ֵK=________��
��3�� ���и�������Ϊ�жϸ÷�Ӧ�ﵽƽ��״̬����____ ���������ĸ����
A��������ѹǿ���ֲ��� B��2v����NO��= v����N2��
C��������CO2������������� D�����������ܶȱ��ֲ���
��4��30 minʱ�ı�ijһ��������Ӧ���´ﵽƽ�⣬��ı������������_____________��
��5��һ���¶��£�����NO����ʼŨ��������NO��ƽ��ת����__________ ����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NaNO2 ����ۺ�ʳ�����ƣ�������ζ������ʹ����ʳ�ж�����֪ NaNO2�ܷ�����Ӧ��2NaNO2��4HI===2NO����I2��2NaI��2H2O��
(1)������Ӧ���������� ________�����ѧʽ��
(2)����������Ӧ������ NaNO2 �� NaCl����ѡ�õ������� ��ˮ���ڵ⻯��������ֽ�۵��ۡ��ܰơ���ʳ�ף�����Ϊ����ѡ�õ�������________(�����)��
(3)����ƽ���»�ѧ����ʽ��____Al��____NaNO3��____ NaOH= ____NaAlO2��____ N2����___H2O
����Ӧ������ת�� 5 mol ���ӣ������ɱ�״���� N2 �����Ϊ_________L��
�������ǻ������������ֺ������绢���������������ִ���ҵ��ζ����������ϡ�����ȶ��ģ������������ܽ���Ũ���������� VO2����
(4)V2O5 �������������ǿ�Ӧ���ɷ�����(������Ϊ VO43��)������ǿ�����ɺ���������(VO2��)���Ρ���д�� V2O5 �ֱ����ռ���Һ��ϡ���ᷴӦ���ɵ��εĻ�ѧʽ��_______��_______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ᣨH2C2O4����һ�ֶ�Ԫ���ᣬ�㷺�ֲ��ڶ�ֲ�����С�
��1�������ڲ����ۻ������ǵ��½�ʯ����Ҫ�ɷ��Dz���ƣ��γɵ�ԭ��֮һ�����о����֣�EDTA��һ���ܽ�Ͻ������ӵ��Լ�����һ�������¿�����Ч�ܽ��ʯ���û�ѧƽ��ԭ��������ԭ��_______________��
��2����֪��0.1 mol��L��1KHC2O4��Һ�����ԡ�����˵����ȷ����_______������ĸ��ţ���
a. 0.1 mol��L��1KHC2O4��Һ�У�c(K+) + c(H+) = c(HC2O4-) + 2c(C2O42-) + c(OH-)
b. 0.1 mol��L��1KHC2O4��Һ�У�c(K+) > c(HC2O4-) > c(C2O42-) > c(H2C2O4)
c. Ũ�Ⱦ�Ϊ0.1 mol��L��1KHC2O4��K2C2O4�Ļ����Һ�У�2c(K+) = c(HC2O4-) + c(C2O42-)
d. 0.1 mol/L KHC2O4��Һ�еμӵ�Ũ��NaOH��Һ�����ԣ�c(K+) > c(Na+)
��3�����ò����Ʊ�������������(FeC2O4��xH2O)�����̼���ֲⶨ�������£�
![]()
��֪��i. pH>4ʱ��Fe2+�ױ���������
ii. �������ʵ��ܽ��(g /100g H2O)����
FeSO4��7H2O | (NH4)2SO4 | FeSO4��(NH4)2SO4��6H2O | |
20�� | 48 | 75 | 37 |
60�� | 101 | 88 | 38 |
����ϡ�������ҺpH��1��2��Ŀ���ǣ�_____________��______________��
�����ȹ��˵�ԭ���ǣ�_______________��
��������ԭ�ζ��������ڲⶨ�������������Ħ������(M)����ȡa g����������������ϡ�����У���b mol��L��1�ĸ�����ر�Һ�ζ�������ζ��յ�ʱ�����ĸ������VmL����M =__________��(��֪�����ַ�Ӧ����ΪMn2+��Fe3+��CO2)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪298Kʱ��Ksp(MnS)=4.65��1014��Ksp(MnCO3)=2.24��1011��298K�£�MnS��MnCO3(R2����S2��CO32-)��ˮ�е��ܽ�������ͼ��ʾ������˵����ȷ����
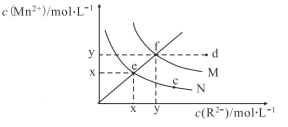
A.ͼ����xԼ����2.2��107
B.�����������䣬����N������Һ��ʹ��Һ�����e����ef����f�㷽���ƶ�
C.�����£���ˮϡ��M��Һ��ʹ��Һ�����d����df����f�㷽���ƶ�
D.����MnS��MnCO3�ı�����Һ�м�����MnCl2��![]() ����
����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com