
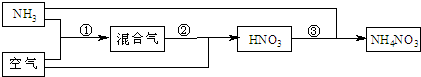
某化肥厂以氨和空气(其中氧气的体积分数为0.2)为原料生产硝酸铵过程如下:

其中反应①为4NH3+5O2![]() 4NO+6H2O
4NO+6H2O
⑴步骤②中发生了两个反应,将这两个化学方程式合并为一个化学方程式,可表示为_____________
________________________。
⑵若不考虑副反应且各步反应均完全,为使生产过程中不再补充空气,则原料气中氨(包括第③步被硝酸吸收的氨)的体积分数最大值为____________。
⑶假设实际生产中,反应①、②中含氮物质的利用率分别为a、b,反应③中氨的利用率为c、硝酸的利用率为100%,则合成硝酸铵的整个流程中,氨的总利用率是多少?
(1)4NO+3O2+2H2O=4HNO3
(2)1/6(或16.7%)
本题考查了在工业流程背景下的化学计算,关键是能够准确的找出各生产原料和产物间的关系,然后根据所找到的比例关系进行相应计算.找关系式的一种方法就是将方程式当作代数式进行相应的消元,得出我们需要的相关物质的关系。
⑴反应②涉及这样几步反应: 2NO+O2 = 2NO2 I
3NO2+H2O = 2HNO3+NO II
I×3+II×2,消去中间物NO2,得 :4NO+3O2 +2H2O = 4HNO3
⑵ 整个过程包括这样几步反应:
4NH3+5O2![]() 4NO+6H2O ①
4NO+6H2O ①
4NO+3O2 +2H2O = 4HNO3 ②
NH3+HNO3 = NH4NO3 ③
①+ ②+③×4,约简得: 2NH3++2O2 = NH4NO3 + H2O
由n(NH3):n(O2)=1:1 推知V(NH3):V(空气)=1:5
(3)![]()
解法一:假设消耗NH3的总物质的量为1mol,其中用于制取HNO3的NH3的物质的量为x mol,被HNO3吸收的NH3的物质的量为ymol,则有:x+y=1、abx=cy。
解得:x=![]() y=
y=![]()
氨的总利用率=(xab+yc)/1=![]()
解法二:假设第①步参加反应的氨气的物质的量为4mol,则:生成硝酸的物质的量4abmol;
第③步需要氨气的物质的量为![]() mol; 氨的总利用率=
mol; 氨的总利用率=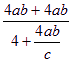 =
=![]()


 灵星计算小达人系列答案
灵星计算小达人系列答案 孟建平错题本系列答案
孟建平错题本系列答案科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
某化肥厂以氨和空气(其中氧气的体积分数为0.2)为原料生产硝酸铵过程如下:

其中反应①为4NH3+5O2![]() 4NO+6H2O
4NO+6H2O
(1)步骤②中发生了两个反应,将这两个化学方程式合并为一个化学方程式,可表示为_____________________________________。
(2)若不考虑副反应且各步反应均完全,为使生产过程中不再补充空气,则原料气中氨
(包括第③步被硝酸吸收的氨)的体积分数最大值为____________。
(3)假设实际生产中,反应①、②中含氮物质的利用率分别为a、b,反应③中氨的利用率为c、硝酸的利用率为100%,则合成硝酸铵的整个流程中,氨的总利用率是多少?(要求写出解题过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
某化肥厂以氨和空气(其中氧气的体积分数为0.2)为原料生产硝酸铵过程如下:

其中反应①为4NH3+5O2![]() 4NO+6H2O
4NO+6H2O
(1)步骤②中发生了两个反应,将这两个化学方程式合并为一个化学方程式,可表示_______
_____________________________。
(2)若不考虑副反应且各步反应均完全,为使生产过程中不再补充空气,则原料气中氨(包括第③步被硝酸吸收的氨)的体积分数最大值为____________。
(3)假设实际生产中,反应①、②中含氮物质的利用率分别为a、b,反应③中氨的利用率为c、硝酸的利用率为100%,则合成硝酸铵的整个流程中,氨的总利用率是多少?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com