
分析 (1)稀盐酸与CaCO3反应生成氯化钙、二氧化碳和水;
(2)在加热条件下,FeCl3水解生成氢氧化铁和HCl.
解答 解:(1)稀盐酸与CaCO3反应生成氯化钙、二氧化碳和水,反应的方程式为:CaCO3+2HCl=CaCl2+H2O+CO2↑;
故答案为:CaCO3+2HCl=CaCl2+H2O+CO2↑;
(2)在加热条件下,FeCl3水解生成氢氧化铁和HCl,反应的方程式为:FeCl3+3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3(胶体)+3HCl;
故答案为:FeCl3+3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3(胶体)+3HCl.
点评 本题考查水解方程式和化学方程式书写、胶体的制备,掌握相关的反应原理是解答的关键,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
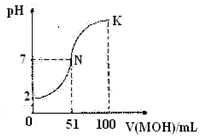
| A. | 在N到K间任意一点对应的溶液中:c(M+)+c(H+)=c(OHˉ)+c(Aˉ) | |
| B. | HA为弱酸 | |
| C. | 常温下,MA溶液的pH>7 | |
| D. | N点水的电离程度小于K点水的电离程度 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| Fe2+ | Fe3+ | Cu2+ | |
| 开始沉淀时pH | |||
| 完全沉淀时pH | 8 | 3.2 | 6.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 我们的祖先很早就学会了烧制陶瓷、冶炼金属、酿造酒类 | |
| B. | 化学研究的主要目的是认识分子 | |
| C. | 化学科学无法帮助研究人员了解疾病的病理 | |
| D. | 意大利化学家阿伏伽德罗提出了原子学说,为近代化学的发展奠定了基础 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com