
向一定量的饱和NaOH溶液中加入少量Na2O固体,恢复到原来温度时,下列说法中正确的是
A.溶液中的Na+总数不变 B.单位体积内的OH-数目不变
C.溶质的物质的量浓度减小 D.溶液的质量不变
 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案科目:高中化学 来源:2016届安徽省等六校教研会高三第一次联考化学试卷(解析版) 题型:选择题
25℃时,下列各组离子在指定溶液中可能大量共存的是
A、无色溶液中: Al3+、NH4+ 、Cl-、S2-
B、由水电离得到的c(H+)=1×10-13mol·L-1的溶液中:Mg2+、Cu2+、SO42-、NO3-
C、0. 1 mol·L-1 NH4HCO3溶液中:K+、Na+、AlO2-、Cl-
D、中性溶液中可能大量存在Fe3+、K+、Cl-、SO42-
查看答案和解析>>
科目:高中化学 来源:2015-2016学年辽宁育才学校高一上第一次阶段测化学试卷(解析版) 题型:选择题
在三个密闭容器中分别充人Ne H2 O2 三种气体,当它们的温度和密度都相同时,这三种气体的压强(p)从大到小的顺序是
A. p(O2)>p(Ne)>p(H2) B. p(H2)>p(Ne)>p(O2)
C. p(H2)>p(O2)>p(Ne) D. p(Ne)>p(H2)>p(O2)
查看答案和解析>>
科目:高中化学 来源:2016届河北省高三上学期四调考试化学试卷(解析版) 题型:选择题
某兴趣小组的同学用下图所示装置研究有关电化学的问题(甲、乙、丙三池中溶质足量),当闭合该装置的电键K时,观察到电流计的指针发生了偏转。一段时间后,断开电键K,下列物质能使乙池恢复到反应前浓度的是
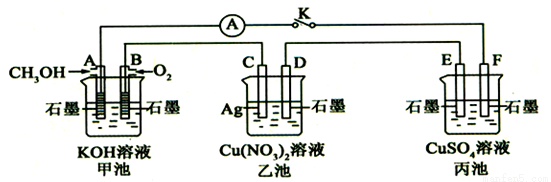
A.Cu B.CuO C.Cu(OH)2 D.Cu2(OH)2CO3
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川省高二上10月月考化学试卷(解析版) 题型:选择题
已知X.Y.Z三种元素组成的化合物是离子晶体,其晶胞如图所示,则下面表示该化合物的化学式正确的是
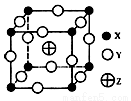
A.ZX4Y8 B.ZX2Y6 C.ZXY3 D.ZX8Y12
查看答案和解析>>
科目:高中化学 来源:2016届吉林省高三上学期第一次模拟化学试卷(解析版) 题型:选择题
某同学采用硫铁矿焙烧取硫后的烧渣(主要成分为Fe2O3、SiO2、Al2O3,不考虑其他杂质)制取绿矾(FeSO4·7H2O),设计了如下流程,下列说法不正确的是

A.溶解烧渣选用足量硫酸,试剂X选用铁粉
B.固体1中一定含有SiO2,控制pH是为了使Al3+转化为Al(OH)3,进入固体2
C.若改变方案,在溶液1中直接加NaOH至过量,得到的沉淀用硫酸溶解,其溶液经结晶分离也可得到FeSO4·7H2O
D.从溶液2得到FeSO4·7H2O产品的过程中,须控制条件防止其氧化和分解
查看答案和解析>>
科目:高中化学 来源:2016届福建省高三上学期10月月考化学试卷(解析版) 题型:实验题
(18分)氮化铝(AlN0是一种新型无机非金属材料。某AlN样品仅含有Al2O3杂质,为测定AlN的含量,设计如下三种实验方案。(已知:AlN+NaOH+H2O=NaAlO2+ NH3↑)
【方案1】取一定量的样品,用以下装置测定样品中AlN的纯度(夹持装置已略去)。

(1)上图C装置中球形干燥管的作用是 。
(2)完成以下实验步骤:组装好实验装置,首先 ,再加入实验药品,接下来的实验操作是 ,打开分液漏斗活塞,加入NaOH浓溶液,至不再产生气体。打开K1,通入氮气一段时间,测定C装置反应前后的质量变化。通入氮气的目的是 。
(3)由于装置存在缺陷,导致测定结果偏高,请提出改进意见 。
【方案2】用下图装置测定m g样品中A1N的纯度(部分夹持装置已略去)。

(4)为测定生成气体的体积,量气装置中的X液体可以是 (填选项序号)。
a.CCl4 b.C6H6 c.NH4Cl溶液 d.H2O
(5)若m g样品完全反应,测得生成气体的体积为VmL(已转换为标准状况),则A1N的质量分数是 (用含m、V的数学表达式表示)。
【方案3】按以下步骤测定样品中A1N的纯度:
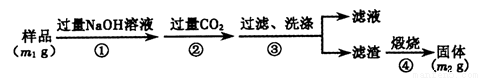
(6)步骤②生成沉淀的离子方程式为 。
(7)若在步骤③中未洗涤,测定结果将 (填“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源:2016届山东省南校区高三上学期10月阶段测化学试卷(解析版) 题型:填空题
(18分)(1)常温下某溶液中由水电离出的离子浓度符合c(H+)·c(OH-)=1×10-20的溶液,其pH为____________,此时水的电离受到______________。
(2)已知:2NO2(g)===N2O4(g)ΔH=-57.20 kJ·mol-1。一定温度下,在密闭容器中反应2NO2(g)===N2O4(g)达到平衡。其他条件不变时,下列措施能提高NO2转化率的是__________(填字母)。
A.减小NO2的浓度 B.降低温度
C.增加NO2的浓度 D.升高温度
(3)在某温度下,H2O的离子积常数为1×10-13 mol2·L-2,则该温度下:
①0.01 mol·L-1NaOH溶液的pH=_____________;
②100 mL 0.1 mol·L-1H2SO4溶液与100 mL 0.4 mol·L-1的KOH溶液混合后,pH=___________。
(4)已知一溶液有4种离子:X+、Y-、H+、OH-,下列分析结果肯定错误的是______________。
A.c(Y-)>c(X+)>c(H+)>c(OH-) B.c(X+)>c(Y-)>c(OH-)>c(H+)
C.c(H+)>c(Y-)>c(X+)>c(OH-) D.c(OH-)>c(X+)>c(H+)>c(Y-)
(5)在25 ℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应时溶液中c(NH4+)=c(Cl-)。则溶液显___________(填“酸”“碱”或“中”)性;用含a的代数式表示NH3·H2O的电离常数Kb=________________。
(6)水溶液中的行为是中学化学的重要内容。已知下列物质的电离常数值(25 ℃):
HClO:Ka=3×10-8 HCN:Ka=4.9×10-10 H2CO3:Ka1=4.3×10-7 Ka2=5.6×10-11
84消毒液中通入少量的CO2,该反应的化学方程式为_____________________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年内蒙古巴彦淖尔高二上10月月考化学试卷(解析版) 题型:选择题
已知1 g氢气完全燃烧生成水蒸气时放出的热量121 kJ,且氧气中1 mol O=O键完全断裂时吸收热量496 kJ,水蒸气中1 molH-O键形成时放出热量463 kJ,氢气中1 molH-H键断裂时吸收热量为
A.920 kJ B.557 kJ C.436 kJ D.188 kJ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com