
| A、0.1mol/L的NH4HSO4溶液中滴加0.1mol/L的Ba(OH)2溶液至沉淀刚好完全:c(NH4+)>c(OH-)>c(SO42-)>c(H+) |
| B、0.1mol/L的KOH溶液中通入标准状况下的CO2气体3.36L,所得溶液中:c(K+)+c(H+)=c(CO32-)+c(HCO3-)+c(OH-) |
| C、0.1mol/L的NaOH溶液与0.2mol/L的HCN溶液等体积混合,所得溶液呈碱性:c(HCN)>c(Na+)>c(CN-)>c(OH-)>c(H+) |
| D、pH相同的NaOH溶液、CH3COONa溶液、Na2CO3溶液、NaHCO3溶液的浓度:c(NaOH)<c(CH3COONa)<c(NaHCO3)<c(Na2CO3) |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| 滴定序号 | 待测液体积∕mL | 消耗KMn04溶液体积∕mL |
| 1 | 25.00 | 19.98 |
| 2 | 25.00 | 19.12 |
| 3 | 25.00 | 20.02 |
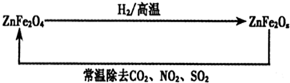
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将氯化铁溶液与碳酸氢钠溶液混合:2Fe3++3HCO3?+3H2O=2Fe(OH)3↓+3CO32? |
| B、向NaAlO2溶液中通入过量CO2气体:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3- |
| C、向AgBr悬浊液中滴加NaI溶液并充分振荡:Ag++I-=AgI↓ |
| D、向NH4HCO3溶液中加入过量烧碱溶液并微热:NH4++OH-=NH3↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、少量NaHSO4溶液与Ba(OH)2溶液混合:S
| ||
| B、醋酸除水垢:CaCO3+2CH3COOH=Ca2++2CH3COO-+CO2↑+H2O | ||
| C、漂白粉溶液中通入过量的CO2:Ca2++2ClO-+CO2+H2O=CaCO3↓+2HClO | ||
| D、少量金属钠放入冷水中:Na+2H2O=Na++2OH-+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下,0.05mol?L-1Fe2(SO4)3溶液中含Fe3+数目为0.1NA |
| B、标准状况下,22.4L甲苯中含C-H数目为8 NA |
| C、常温、常压下,1.6g O2和O3混合物中,氧原子的数目为0.1NA |
| D、0.1mol Na2O2与足量CO2反应时,转移的电子数目为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溶液中由水电离出的c(H+),前者是后者的10m-n倍 |
| B、25℃时等浓度的CH3COONa和NaCN溶液,后者pH大 |
| C、HCN溶液和NaOH溶液混合后一定存在:c(H+)-c(OH-)=c (CN-)-c(Na+) |
| D、常温下将pH相同的CH3COOH和HCN溶液稀释相同的倍数时,前者pH变化小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、空气:CH4、CO2、SO2、NO |
| B、银氨溶液:Na+、H+、NO3-、NH4+ |
| C、pH=2的溶液:H+、K+、Cl-、Br- |
| D、高锰酸钾溶液:H+、Na+、SO42-、HCOOH |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 化学式 | AgCl | AgBr | AgI |
| 颜 色 | 白色 | 浅黄色 | 黄色 |
| Ksp | 2.0×10-10 | 5.4×10-13 | 8.3×10-17 |
+ 4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com