
【题目】下列物质中,既不属于电解质也不属于非电解质的是( )
A. NaOHB. C2H5OHC. 食盐水D. CaCO3
科目:高中化学 来源: 题型:
【题目】PbO2受热分解为Pb的+4和+2价的混合氧化物,+4价的Pb能氧化浓盐酸生成Cl2;现将1mol PbO2加热分解得到O2 , 向剩余固体中加入足量的浓盐酸得到Cl2 , O2和Cl2的物质的量之比为1:1,则剩余固体的组成及物质的量比可能是( )
A.1:2:1混合的PbO2、Pb3O4、PbO
B.1:3:2混合的PbO2、Pb3O4、PbO
C.1:1:1混合的PbO2、Pb3O4、PbO
D.2:1:1混合的PbO2、Pb3O4、PbO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知短周期元素的四种离子A2+、B+、C3-、D-具有相同的电子层结构,则下列叙述中正确的是
A. 原子序数:D>C>B>A B. 原子半径:B>A>C>D
C. 离子半径:C3->D->A2+>B+ D. 氧化性:A2+>B+,还原性:C3-<D-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两种金属元素M和N,其中M单质是人类使用最广泛和最多的金属,N元素的氧化物和氢氧化物均具有两性,它们的单质及化合物有着各自的性质.
(1)在一定温度下,氧化M可以与一氧化碳发生下列反应:M2O3(s)+3CO(g)2M(s)+3CO2(g)
①元素M名称 , 该反应的平衡常数表达式为:K= .
②该温度下,在2L盛有M2O3粉末的密闭容器中通入CO气体,10min后,生成了单质M11.2g,则10min内CO的平均反应速率为 .
(2)请用上述反应中某种气体的有关物理量来说明该反应已达到平衡状态:
① , ②
(3)某些金属氧化物粉末和N单质粉末状固体在镁条的引燃下可以发生反应.下列反应速率(v)和温度(T)的关系示意图中与该反应最接近的是 . 
(4)写出N的氢氧化物在水中发生碱式电离的电离方程式: , 欲使上述平衡体系中N简单阳离子浓度增加,可加入的物质是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲同学利用下图所示装置进行硝酸、氮氧化物的相关实验:
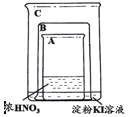
实验1:将铜片放入烧杯A后,立即用烧杯B盖住
(1)烧杯A液体上方出现大量红棕色气体,该反应的化学方程式为_________________
(2)一段时间后,红棕色气体消失,烧杯C中的液体变成蓝色,甲同学分析出现蓝色的原因,认为其中涉及到两个反应:
①红棕色气体消失,该化学方程式为_____________________________________________
②配平溶液出现蓝色的离子方程式,并用单线桥法标出电子转移方向和数目:
________I-+________![]() +________H+=________I2+________NO↑+________H2O
+________H+=________I2+________NO↑+________H2O
(3)打开烧杯B,A液体上方又出现淡棕色,该反应的化学方程式为__________________
实验Ⅱ:因为有其他同学对淀粉KI溶液变蓝的原因提出异议,甲同学将铜片换成铁片放入烧杯A后,立即用烧杯B盖住。
(4)实验前甲同学认为换为铁片后不应出现红棕色气体,淀粉KI溶液不会变为蓝色,其理由是____________________________________________________________________
(5)实验开始后,发现确实无红棕色气体生成,但过一段时间后,淀粉KI溶液仍然变为蓝色,请你帮忙分析其中的原因_________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通常把断裂1mol某化学键所吸收的能量称为键能。键能的大小可以衡量化学键的强弱,也可以估算化学反应的反应热(用△H表示,放热反应的△H<0,吸热反应的△H>0),△H=反应物总键能-生成物总键能。
已知:N≡N键、H-H键和N-H键的链能分别记作a、b和c(单位:kJ·mol-1)合成氨反应的能量变化关系如图所示。
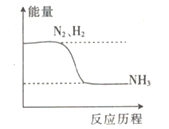
回答下列问题:
(1)生成1molNH3要___________(填“吸收”或“放出”)热量________(用含a、b、c的代数式表示)kJ。
(2)NH3分解生成N2和1molH2要_________(填“吸收”或“放出”)热量____________(用含a、b、c的代数式表示)kJ。
(3)事实上,反应的热量总小于理论值,原因可能是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究催化剂对化学反应有重要意义.为探究催化剂对双氧水分解的催化效果,某研究小组做了如下实验: 
(1)甲同学欲用上图所示实验来证明MnO2是H2O2分解反应的催化剂,写出该反应的化学方程式
(2)为探究MnO2的质量对催化效果的影响,乙同学分别量取50mL 1% H2O2加入容器中,在一定质量范围内,加入不同质量的MnO2 , 测量所得气体体积,数据如表:
MnO2的质量/g | 0.1 | 0.2 | 0.4 |
40s末O2体积/mL | 49 | 61 | 86 |
由此得出的结论是 .
(3)为分析Fe3+和Cu2+对H2O2分解反应的催化效果,丙同学设计如表实验(三支试管中均盛有10mL 5% H2O2 ):
试管 | Ⅰ | Ⅱ | Ⅲ |
滴加试剂 | 5滴0.1molL﹣1FeCl3 | 5滴0.1molL﹣1 CuCl2 | 5滴0.3molL﹣1 NaCl |
产生气 | 较快产生细小气泡 | 缓慢产生细小气泡 | 无气泡产生 |
结论是 , 实验Ⅲ的目的是 .
(4)查阅资料得知:将作为催化剂的FeCl3溶液加入H2O2溶液后,溶液中会发生两个氧化还原反应,且两个反应中H2O2均参加了反应,试从催化剂的角度分析,这两个氧化还原反应的化学方程式分别是2FeCl3+H2O2=2FeCl2+O2↑+2HCl和 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用酸碱中和滴定的方法测定NaOH和Na2CO3的混合液中的NaOH含量时,可先在混合液中加过量的BaCl2溶液,使Na2CO3完全变成BaCO3沉淀,然后用标准盐酸滴定(用酚酞作指示剂),下列有关实验的说法正确的是( )
A.向混有BaCO3沉淀的NaOH溶液中滴入盐酸,不会影响NaOH含量的测定
B.滴定时,若滴定管中滴定液一直下降到活塞处才达到滴定终点,则不会影响计算结果
C.若用甲基橙作指示剂,则测定结果偏小
D.可以不用将Na2CO3完全变成BaCO3沉淀,直接滴加标准盐酸,至不再有气泡产生
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com